Hvorfor er alken mere reaktiv end alkan?
1. Elektrondensitet og reaktivitet:
* alkenes: Den dobbelte binding i alkener indeholder en lokaliseret region med høj elektrondensitet. Dette gør elektronerne i dobbeltbindingen modtagelige for angreb fra elektrofiler (elektron-søgende arter).
* alkanes: Alkaner har kun enkeltbindinger, som er relativt stabile og mindre tilbøjelige til at angribe.
2. PI Bond:
* alkenes: Dobbeltbindingen består af en Sigma -obligation (stærk) og en PI -binding (svagere). PI -bindingen er mindre stabil og lettere brudt, hvilket gør molekylet mere reaktivt.
* alkanes: Alkaner har kun Sigma -obligationer, som er stærkere og mindre tilbøjelige til at bryde.
3. Elektrofil angreb:
* alkenes: Den høje elektrondensitet i dobbeltbindingen tiltrækker elektrofiler. Elektrofiler kan angribe dobbeltbindingen, hvilket får den til at bryde og danne nye bindinger.
* alkanes: Alkaner gennemgår ikke let elektrofilt angreb på grund af manglen på let tilgængelig elektrondensitet.
4. Tilføjningsreaktioner:
* alkenes: Alkener gennemgår let tilsætningsreaktioner, hvor dobbeltbindingen er brudt, og nye atomer tilsættes til kulstofkæden. Dette er en nøgleegenskab, der gør dem mere reaktive.
* alkanes: Alkaner gennemgår primært substitutionsreaktioner, hvor et atom eller gruppe erstattes af en anden. Disse reaktioner kræver generelt højere temperaturer og mere ekstreme forhold.
Kortfattet:
Tilstedeværelsen af dobbeltbindingen i alkener gør dem mere reaktive end alkaner. Dette skyldes den højere elektrondensitet, svagere PI -binding og evnen til let at gennemgå elektrofile angreb og tilsætningsreaktioner.
 Varme artikler
Varme artikler
-
 Glycaner fandt binding til pattedyr -RNAKredit:CC0 Public Domain Et team af forskere ved Stanford University har fundet tegn på glycaner, der binder sig til pattedyr -RNA. Gruppen har skrevet et papir, der beskriver deres resultater og
Glycaner fandt binding til pattedyr -RNAKredit:CC0 Public Domain Et team af forskere ved Stanford University har fundet tegn på glycaner, der binder sig til pattedyr -RNA. Gruppen har skrevet et papir, der beskriver deres resultater og -
 Forskere fremmer indsatsen for nøjagtigt at måle glyphosat-pesticid i havrePrøver af havregryn og havrebaserede produkter analyseret for glyphosat og AMPA. Kredit:J. Murray/NIST Pesticider hjælper landmænd med at øge fødevareproduktionen, reducere dyre skader på afgrøder
Forskere fremmer indsatsen for nøjagtigt at måle glyphosat-pesticid i havrePrøver af havregryn og havrebaserede produkter analyseret for glyphosat og AMPA. Kredit:J. Murray/NIST Pesticider hjælper landmænd med at øge fødevareproduktionen, reducere dyre skader på afgrøder -
 Forskere finder en måde at skrælle slimede biofilm som gamle klistermærkerKredit:Princeton University Slimet, svært at rengøre bakteriemåtter kaldet biofilm forårsager problemer lige fra medicinske infektioner til tilstoppede afløb og tilsmudset industriudstyr. Nu, fors
Forskere finder en måde at skrælle slimede biofilm som gamle klistermærkerKredit:Princeton University Slimet, svært at rengøre bakteriemåtter kaldet biofilm forårsager problemer lige fra medicinske infektioner til tilstoppede afløb og tilsmudset industriudstyr. Nu, fors -
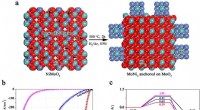 Ny metode til syntese af molekylært hydrogen sætter benchmark for platinfri elektrokatalysatorerFigur. a) Syntetisk skema af MoNi4 elektrokatalysator understøttet af MoO2 kuboiderne på nikkelskum; b) polarisationskurver for MoNi4 elektrokatalysatoren understøttet af MoO2 kuboiderne, rene Ni nano
Ny metode til syntese af molekylært hydrogen sætter benchmark for platinfri elektrokatalysatorerFigur. a) Syntetisk skema af MoNi4 elektrokatalysator understøttet af MoO2 kuboiderne på nikkelskum; b) polarisationskurver for MoNi4 elektrokatalysatoren understøttet af MoO2 kuboiderne, rene Ni nano
- Ultrastabil, udviklet selektiv katalysator til propandehydrogenering
- I hvilken stat er det kontinentale kløft placeret?
- Hvad er navnene på enkle videnskabelige objekter?
- Forsker siger, at en kvindes lønseddel er nøglen til at bestemme, hvor meget husarbejde hun udfør…
- Hvordan køler du en by i en opvarmende verden?
- Skræddersyet kulstof kan hjælpe forskere med at finde arvelige sygdomme og de rigtige doser af med…


