Hvorfor danner fluorbindinger med næsten alle elementer på den periodiske tabel?
* Høj elektronegativitet: Fluor har den højeste elektronegativitet af alle elementer. Dette betyder, at det har en stærk attraktion for elektroner, hvilket gør den meget reaktiv.
* lille atomradius: Fluor er den mindste halogen, hvilket resulterer i en koncentreret elektronsky. Denne lille størrelse giver den mulighed for at komme tæt på andre atomer og lette dannelsen af binding.
* stærk oxidationseffekt: Fluor er et meget stærkt oxidationsmiddel. Dette betyder, at det let får elektroner fra andre elementer og danner ioniske eller kovalente bindinger.
* Dissociation Energy: Bindingen mellem fluoratomer (F-F) er relativt svagt, hvilket betyder, at det let bryder for at danne bindinger med andre elementer.
Sammenfattende bidrager disse egenskaber til fluorens reaktivitet og evne til at danne bindinger med en lang række elementer.
Det er vigtigt at bemærke, at selvom fluor kan danne bindinger med mange elementer, danner det ikke bindinger med dem alle. For eksempel vides det ikke at danne stabile forbindelser med ædelgasser som helium og neon.
 Varme artikler
Varme artikler
-
 Destabiliseringsprocesser i skumEn stabilisator danner en netlignende struktur på en lille luftboble og understøtter den således. Kredit:ETH Zürich Oktoberfest er en spændende kulturbegivenhed, men det er også en inspirationskil
Destabiliseringsprocesser i skumEn stabilisator danner en netlignende struktur på en lille luftboble og understøtter den således. Kredit:ETH Zürich Oktoberfest er en spændende kulturbegivenhed, men det er også en inspirationskil -
 Nyt twist på CRISPR-teknologiUniversity of Delaware doktorand Emily Berckman (til venstre) og prof. Wilfred Chen har fundet en ny måde at bruge CRISPR -teknologi, der vil hjælpe kemikere, biokemikere og ingeniører, der arbejder m
Nyt twist på CRISPR-teknologiUniversity of Delaware doktorand Emily Berckman (til venstre) og prof. Wilfred Chen har fundet en ny måde at bruge CRISPR -teknologi, der vil hjælpe kemikere, biokemikere og ingeniører, der arbejder m -
 Produktion af genanvendeligt plastik et skridt nærmereDe stjerneformede polymerer bytter bindinger. Kredit:Eindhoven University of Technology En nyligt opdaget gruppe af genanvendelig plast ser ud til at være et lovende alternativ til den hårde plast
Produktion af genanvendeligt plastik et skridt nærmereDe stjerneformede polymerer bytter bindinger. Kredit:Eindhoven University of Technology En nyligt opdaget gruppe af genanvendelig plast ser ud til at være et lovende alternativ til den hårde plast -
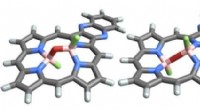 Opdagelse til at gruppere atomer påkalder PasteurForskernes molekyler ændrer form ved, at det centrale oxygenatom (vist med rødt) bøjer sig som et hængsel. De venstre og højre billeder viser, hvad formerne på disse molekyler er, når de er stabile. H
Opdagelse til at gruppere atomer påkalder PasteurForskernes molekyler ændrer form ved, at det centrale oxygenatom (vist med rødt) bøjer sig som et hængsel. De venstre og højre billeder viser, hvad formerne på disse molekyler er, når de er stabile. H
- Hvad er 4 hoveddele af en virus?
- Er solens mulige død på det tidspunkt et problem, du bør bekymre dig om?
- Når reflekteret lys springer tilbage på det samme, hvor det ramte et objekt?
- Jorden snurrer hurtigere end normalt, men hvorfor? Hvad eksperter siger efter den korteste dag nogen…
- Hvordan reducerer mennesker mangfoldighed i økosystemer?
- Hvilken kraft er imod tyngdekraften, når et blad falder?


