Hvorfor har kovalente molekyler ingen gebyr?
* Deling af elektroner: I kovalente bindinger deler atomer elektroner snarere end at overføre dem som i ioniske bindinger. Denne deling skaber en afbalanceret fordeling af elektroner mellem de involverede atomer.
* Lige deling (ikke -polære obligationer): Når to atomer med samme elementbinding, deler de elektroner lige. Dette resulterer i en ikke -polær kovalent binding, hvor elektrondensiteten fordeles jævnt, hvilket resulterer i ingen samlet ladning.
* ulig deling (polære obligationer): Selv når atomer af forskellige elementer deler elektroner, er delingen ofte ulige. Dette skaber en polær kovalent binding, hvor det ene atom har en lidt negativ ladning og den anden har en lidt positiv ladning. Imidlertid forbliver det samlede molekyle neutral, fordi ladningerne er afbalanceret inden for molekylet.
Eksempel:
* vand (H₂O): Oxygenatomet i vand er mere elektronegativ end hydrogenatomerne. Dette betyder, at iltatomet tiltrækker de delte elektroner stærkere, hvilket gør det lidt negativt (Δ-) og hydrogenatomerne lidt positive (Δ+). Molekylet som helhed er imidlertid neutral, fordi de positive og negative ladninger annullerer hinanden.
Undtagelser:
Mens de fleste kovalente molekyler er neutrale, er der nogle undtagelser:
* polyatomiske ioner: Molekyler som ammonium (NH₄⁺) og hydroxid (OH⁻) har en nettoafgift på grund af tilstedeværelsen af yderligere eller færre elektroner. Disse molekyler betragtes som polyatomiske ioner.
* opladede radikaler: Nogle kovalente molekyler kan eksistere med en uparret elektron, hvilket gør dem til radikaler med en nettoafgift. F.eks. Superoxidradikalen (O₂⁻).
Generelt fører imidlertid deling af elektroner i kovalente bindinger til en neutral samlet ladning for molekylet.
 Varme artikler
Varme artikler
-
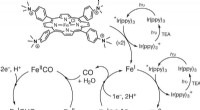 Omdannelse af kuldioxid til metan ved hjælp af jern og sollysSkitse af den foreslåede mekanisme til CO2 -reduktion til CH4 ved katalysator 1. Kredit: Natur (2017). DOI:10.1038/nature23016 (Phys.org) - Et kombineret team af forskere fra Université Paris Did
Omdannelse af kuldioxid til metan ved hjælp af jern og sollysSkitse af den foreslåede mekanisme til CO2 -reduktion til CH4 ved katalysator 1. Kredit: Natur (2017). DOI:10.1038/nature23016 (Phys.org) - Et kombineret team af forskere fra Université Paris Did -
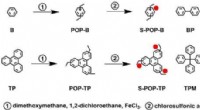 Et enkelt og universelt design til brændselscelleelektrolytDesign og syntese af POPer og sulfonerede POPer (S-POPer). Kredit:JAIST Forskere ved Japan Advanced Institute of Science and Technology (JAIST) og Dalian Institute of Chemical Physics, det kinesis
Et enkelt og universelt design til brændselscelleelektrolytDesign og syntese af POPer og sulfonerede POPer (S-POPer). Kredit:JAIST Forskere ved Japan Advanced Institute of Science and Technology (JAIST) og Dalian Institute of Chemical Physics, det kinesis -
 Forskere udvikler ultrastærke aerogeler med materialer, der bruges i skudsikre vesteAerogelerne har ønskværdige egenskaber såsom letvægts, semi-transparent og høj belastningsbærende evne. Kredit:University of Hong Kong Aerogeler er lette materialer med omfattende porer i mikroskal
Forskere udvikler ultrastærke aerogeler med materialer, der bruges i skudsikre vesteAerogelerne har ønskværdige egenskaber såsom letvægts, semi-transparent og høj belastningsbærende evne. Kredit:University of Hong Kong Aerogeler er lette materialer med omfattende porer i mikroskal -
 Ny teknik til at karakterisere kemisk sammensætning og struktur af prøverKredit:Forance, Shutterstock Raman -spektroskopi er en væsentlig teknik, der bruges til undersøgelse af materialer - herunder nanostrukturer - og biologiske systemer til at analysere deres sammens
Ny teknik til at karakterisere kemisk sammensætning og struktur af prøverKredit:Forance, Shutterstock Raman -spektroskopi er en væsentlig teknik, der bruges til undersøgelse af materialer - herunder nanostrukturer - og biologiske systemer til at analysere deres sammens
- Bottom-up syntese af krystallinske 2-D polymerer
- Er energien fra solen en vedvarende eller ikke-vedvarende ressource?
- Lydende raketmission for at give et øjebliksbillede af solens magnetfelt
- Den første store superledende komponent til den nye partikelaccelerator med høj effekt ankommer ti…
- Over 100 brandforskere opfordrer det amerikanske vest:Spring fyrværkeriet over denne rekordtørre f…
- Miljøomkostninger ved hurtig mode er ikke bæredygtige


