Hvad er forskellen mellem et nitrogenatom N og ion N3?
nitrogenatom (n):
* opladning: Neutral (uden gebyr)
* Elektronkonfiguration: 1S² 2S² 2P³
* antal elektroner: 7 (lig med dets antal protoner)
* Antal protoner: 7
* Antal neutroner: 7 (i den mest almindelige isotop)
nitrogenion (n³⁻):
* opladning: -3 (tre negative afgifter)
* Elektronkonfiguration: 1S² 2S² 2P⁶
* antal elektroner: 10 (3 mere end dets antal protoner)
* Antal protoner: 7
* Antal neutroner: 7 (i den mest almindelige isotop)
Nøgleforskelle:
* opladning: Nitrogenatomet er neutralt, mens nitrogenionen har en -3 -ladning.
* Elektronkonfiguration: Nitrogenatomet har 5 valenselektroner i sin yderste skal (2p). Nitrogenionen ved at få tre elektroner fylder sin 2p -skal og opnår en stabil oktetkonfiguration.
* antal elektroner: Nitrogenionen har yderligere tre elektroner end nitrogenatomet.
Dannelse af n³⁻:
Nitrogenatomer kan få tre elektroner til at danne en nitridion (n³⁻). Denne proces kaldes reduktion , når nitrogenatomet får elektroner. Dette resulterer i en stabil ion med en komplet oktet af elektroner i dens yderste skal.
Kortfattet:
Nitrogenatomet er en neutral art med 5 valenselektroner, mens nitridionen (n³⁻) er en negativt ladet art med en komplet oktetkonfiguration opnået ved at få tre elektroner.
 Varme artikler
Varme artikler
-
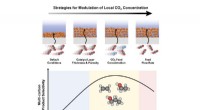 En ny strategi for optimal elektroreduktion af CO2 til højværdiprodukterTre strategier anvendt i denne undersøgelse til at modulere lokal CO2-koncentration i et katalysatorlag (øverst) og forholdet mellem lokal CO2-koncentration og selektiviteten for multi-carbon-produkte
En ny strategi for optimal elektroreduktion af CO2 til højværdiprodukterTre strategier anvendt i denne undersøgelse til at modulere lokal CO2-koncentration i et katalysatorlag (øverst) og forholdet mellem lokal CO2-koncentration og selektiviteten for multi-carbon-produkte -
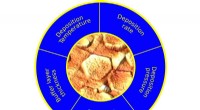 Statistiske design fremskynder optimeringen af lagdelte 2-D krystallerOptimering og vækst af tekstur Sb 2 Te 3 krystal ved statistisk design af eksperiment (DoE). Statistisk signifikante aflejringsfaktorer såsom temperatur, tryk, vækstrate, buffermaterialer, og buff
Statistiske design fremskynder optimeringen af lagdelte 2-D krystallerOptimering og vækst af tekstur Sb 2 Te 3 krystal ved statistisk design af eksperiment (DoE). Statistisk signifikante aflejringsfaktorer såsom temperatur, tryk, vækstrate, buffermaterialer, og buff -
 Effektiv depolymerisering i fast tilstand af affald PETKredit:ChemSusChem Plastforurening er blevet et af de mest komplekse miljøspørgsmål, især i forbindelse med stigende produktion og efterspørgsel efter plastmaterialer. Mens innovationer inden for
Effektiv depolymerisering i fast tilstand af affald PETKredit:ChemSusChem Plastforurening er blevet et af de mest komplekse miljøspørgsmål, især i forbindelse med stigende produktion og efterspørgsel efter plastmaterialer. Mens innovationer inden for -
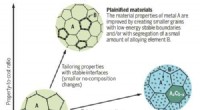 Plainification lover at forbedre materielle bæredygtighedMaterialernes ydeevne forbedres ofte ved at stabilisere grænseflader mellem korn ved at legere med andre elementer. (Billede af SYNL) Omfattende legering gør materialeudvikling mere afhængig af kn
Plainification lover at forbedre materielle bæredygtighedMaterialernes ydeevne forbedres ofte ved at stabilisere grænseflader mellem korn ved at legere med andre elementer. (Billede af SYNL) Omfattende legering gør materialeudvikling mere afhængig af kn
- Hvordan påvirker justeringen af solmåne og jord tidevandsrækkevidde?
- Har Neptune liv på det?
- Kroppen er afhængig af tusinder af sukker -proteinkomplekser for at forblive sund
- Anmeldelse:Et kig på tilbud på den nye mobile platform Quibi
- Hvorfor er ilt vigtigt for luft?
- Hvad er en forbrændingsreaktion?


