Hvad er den empiriske formel og molekylær af en forbindelse med molær masse 245,8 g sammensætningen 19,53 C 2,44 h 13,02 o 65,01 BR?
1. Empirisk formel
* Antag en 100 g prøve: Dette gør, at procenterne direkte oversættes til gram.
* Konverter gram til mol: Del hvert elements masse med dets molære masse:
* C:19,53 g / 12,01 g / mol =1,626 mol
* H:2,44 g / 1,01 g / mol =2,416 mol
* O:13,02 g / 16,00 g / mol =0,814 mol
* BR:65,01 g / 79,90 g / mol =0,813 mol
* Find det enkleste forhold mellem hele nummer: Del hver molværdi med den mindste molværdi (0,813 mol):
* C:1.626 mol / 0,813 mol ≈ 2
* H:2,416 mol / 0,813 mol ≈ 3
* O:0,814 mol / 0,813 mol ≈ 1
* BR:0,813 mol / 0,813 mol ≈ 1
* Empirisk formel: Den empiriske formel er c₂h₃obr
2. Molekylær formel
* Beregn den empiriske formelmasse: (2 * 12.01) + (3 * 1,01) + 16,00 + 79,90 =138,95 g/mol
* Bestem forholdet mellem molekylmassen og empirisk formelmasse: 245,8 g/mol/138,95 g/mol ≈ 1,77
* Multiplicer underskrifterne i den empiriske formel med forholdet: Da forholdet er tæt på 1,77, kan vi runde det til 2.
* C₂h₃obr * 2 = c₄h₆o₂br₂
Derfor er den empiriske formel c₂h₃obr, og den molekylære formel er c₄h₆o₂br₂.
Sidste artikelEr jernoxid en blanding eller forbindelse?
Næste artikelHvad er ionladningen for et nitrogen med 10 elektroner?
 Varme artikler
Varme artikler
-
 Fremskridt højtemperaturelektrolyse:Spaltning af vand for at lagre energi som brintKredit:CC0 Public Domain Mens energikilder som vind og sol er gode til at producere emissionsfri elektricitet, de er afhængige af solen og vinden, så udbuddet opfylder ikke altid efterspørgslen. L
Fremskridt højtemperaturelektrolyse:Spaltning af vand for at lagre energi som brintKredit:CC0 Public Domain Mens energikilder som vind og sol er gode til at producere emissionsfri elektricitet, de er afhængige af solen og vinden, så udbuddet opfylder ikke altid efterspørgslen. L -
 Lysemitterende elektrokemiske celler til genanvendelig belysningKredit:Technical University München En lavpris og let at fremstille lysteknologi kan fremstilles med lys-emitterende elektrokemiske celler. Sådanne celler er tyndfilm elektroniske og ioniske enhede
Lysemitterende elektrokemiske celler til genanvendelig belysningKredit:Technical University München En lavpris og let at fremstille lysteknologi kan fremstilles med lys-emitterende elektrokemiske celler. Sådanne celler er tyndfilm elektroniske og ioniske enhede -
 Solbrændstoffer fungerer godt under pres(Fra l-r) Efstathios Tingas og Wonsik Song diskuterer resultaterne af undersøgelsen med professor Hong Im. Kredit:KAUST Dylan Finol Meget brændstofeffektive nye motordesign kan reducere køretøjers
Solbrændstoffer fungerer godt under pres(Fra l-r) Efstathios Tingas og Wonsik Song diskuterer resultaterne af undersøgelsen med professor Hong Im. Kredit:KAUST Dylan Finol Meget brændstofeffektive nye motordesign kan reducere køretøjers -
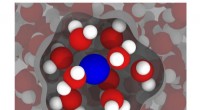 Moderne simuleringer kan forbedre MRI'erEn illustration baseret på simuleringer fra Rice Universitys ingeniører viser en gadoliniumion (blå) i vand (rød og hvid), med vand i den indre sfære - det vand, der er mest påvirket af gadolinium - f
Moderne simuleringer kan forbedre MRI'erEn illustration baseret på simuleringer fra Rice Universitys ingeniører viser en gadoliniumion (blå) i vand (rød og hvid), med vand i den indre sfære - det vand, der er mest påvirket af gadolinium - f
- At tilføje energi eller øge hastigheden af partikler ved meget lavt tryk i et fast stof ville fo…
- Nanosikkerhedsforskning:Jagten på guldstandarden
- Hvordan omdanner man acetylen til ethanol?
- Hvem opfandt radioen?
- Hvad var Albert Einsteins ambitioner?
- Hvad er et opløselighedsprodukt af calciumchlorid?


