Hvordan reagerer brint forskelligt end halogen?
Hydrogen
* Elektronisk konfiguration: 1S¹ (en valenselektron)
* Elektronegativitet: 2.2 (relativt lav)
* reaktivitet:
* danner både kationer og anioner:
* Kan miste sin elektron til dannelse af en +1 ion (H +) - karakteristisk for syrer.
* Kan få et elektron til dannelse af en -1 ion (H-) -fundet i metalhydrider.
* reagerer med ikke -metaller til dannelse af kovalente forbindelser: Eksempler inkluderer vand (H₂O), ammoniak (NH₃) og metan (CH₄).
* reagerer med metaller for at danne ioniske forbindelser: Eksempler inkluderer natriumhydrid (NAH) og lithiumhydrid (LIH).
halogener
* Elektronisk konfiguration: ns²np⁵ (syv valenselektroner)
* Elektronegativitet: Høj (lige fra 2,2 for fluor til 2,66 for jod)
* reaktivitet:
* stærke oxidationsmidler: Få let et elektron til dannelse af en -1 ion (halogenid ion - f⁻, cl⁻, br⁻, i⁻)
* reagerer med metaller for at danne ioniske forbindelser: Eksempler inkluderer natriumchlorid (NaCl), kaliumbromid (KBR) og sølviodid (AGI).
* reagerer med ikke -metaller til dannelse af kovalente forbindelser: Eksempler inkluderer hydrogenfluorid (HF), chlordioxid (Clo₂) og brom trifluorid (BRF₃).
Nøgleforskelle:
* Elektronaffinitet: Halogener har en meget højere elektronaffinitet end brint, hvilket gør dem mere tilbøjelige til at få elektroner og fungere som oxidationsmidler.
* binding: Hydrogen kan danne både ioniske og kovalente bindinger, mens halogener primært danner ioniske bindinger med metaller og kovalente bindinger med ikke -metaller.
* Oxidation siger: Hydrogen kan udvise både positive (+1) og negative (-1) oxidationstilstande, mens halogener næsten altid har en -1 -oxidationstilstand.
Eksempler på reaktioner:
* brint:
* H₂ + cl₂ → 2HCI (kovalent forbindelse)
* 2NA + H₂ → 2NAH (ionisk forbindelse)
* halogener:
* 2NA + CL₂ → 2NACL (ionisk forbindelse)
* Cl₂ + H₂O → HCL + HOCl (kovalent forbindelse)
Sammendrag:
Hydrogen og halogener udviser på trods af ikke -metaller tydelige kemiske adfærd på grund af deres elektroniske konfigurationer og elektronegativitet. Hydrogen kan danne både ioniske og kovalente bindinger, mens halogener typisk oxideres midler, der danner ioniske bindinger med metaller og kovalente bindinger med ikke -metaller.
 Varme artikler
Varme artikler
-
 Partikelstørrelsen har betydning for porøse byggestenTynde (venstre) og tykke film lavet af porøse nanopartikler af calcium og silikat reagerede forskelligt under tryk som testet i et Rice University laboratorium. Partikler i de tynde film flyttede sig
Partikelstørrelsen har betydning for porøse byggestenTynde (venstre) og tykke film lavet af porøse nanopartikler af calcium og silikat reagerede forskelligt under tryk som testet i et Rice University laboratorium. Partikler i de tynde film flyttede sig -
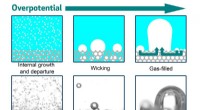 Kontrol af bobledannelse på elektroderDette billede viser samspillet mellem elektrodefugtbarhed, porøs struktur, og overpotentiale. Med nedsat fugtbarhed (bevæger sig til venstre mod højre), den gasudviklende elektrode overgår fra en inte
Kontrol af bobledannelse på elektroderDette billede viser samspillet mellem elektrodefugtbarhed, porøs struktur, og overpotentiale. Med nedsat fugtbarhed (bevæger sig til venstre mod højre), den gasudviklende elektrode overgår fra en inte -
 Vandmolekyler er guld til nanokatalyseKredit:CC0 Public Domain Nanokatalysatorer lavet af guld nanopartikler spredt på metaloxider er meget lovende for industri, selektiv oxidation af forbindelser, inklusive alkoholer, til værdifulde
Vandmolekyler er guld til nanokatalyseKredit:CC0 Public Domain Nanokatalysatorer lavet af guld nanopartikler spredt på metaloxider er meget lovende for industri, selektiv oxidation af forbindelser, inklusive alkoholer, til værdifulde -
 Molekylær tweak forbedrer organisk solcelleydelseDet nye elektron-accepterende molekyle TACIC kan opretholde sin spændte tilstand 50 gange længere end en konventionel. Kredit:Mindy Takamiya En molekylær tweak har forbedret organiske solcellers y
Molekylær tweak forbedrer organisk solcelleydelseDet nye elektron-accepterende molekyle TACIC kan opretholde sin spændte tilstand 50 gange længere end en konventionel. Kredit:Mindy Takamiya En molekylær tweak har forbedret organiske solcellers y
- Hvad kaldes det, når bladet tag dannet af høje træer?
- UK Met Office måler den varmeste februardag nogensinde
- Hvordan vaccinerer man en honningbi? Seks spørgsmål besvaret om nyt værktøj til beskyttelse af b…
- Cellulose -nanogeneratorer kunne en dag drive implanterede biomedicinske enheder
- En ny måde at producere rent brintbrændstof fra vand ved hjælp af sollys
- Discovery booster teorien om, at liv på Jorden opstod fra RNA-DNA-blanding


