Hvor meget jern kræves for at reagere med 48,0 gram svovl i reaktionen 2Fe plus 3s giver Fe2S3?
1. Afbalanceret kemisk ligning:
Den afbalancerede kemiske ligning er:
2Fe + 3S → Fe₂s₃
2. Konverter gram svovl til mol:
* Find den molære masse af svovl (r):32,06 g/mol
* Opdel massen af svovl med dens molære masse:
48,0 g s / 32,06 g / mol =1,497 mol s
3. Brug molforhold fra den afbalancerede ligning:
* Den afbalancerede ligning viser et forhold på 2:3 molen mellem Fe og S.
* For hver 3. mol af S har vi brug for 2 mol Fe.
* Beregn molen for Fe nødvendigt:(1,497 mol S) * (2 mol Fe / 3 mol s) =0,998 mol Fe
4. Konverter mol af jern til gram:
* Find den molære masse af jern (Fe):55,845 g/mol
* Multiplicer molen af Fe med dens molære masse:
(0,998 mol Fe) * (55,845 g/mol) =55,7 g Fe
Svar: Du har brug for cirka 55,7 gram jern at reagere fuldstændigt med 48,0 gram svovl.
 Varme artikler
Varme artikler
-
 Ny krystalteknisk strategi til at designe ultralyse fluorescerende faste farvestofferNår det kommer til at designe ultralyse solid-state fluorescerende materialer, kan brobyggede krystaldesign være nøglen til at muliggøre monomer emission og få adgang til nye krystallinske systemer, a
Ny krystalteknisk strategi til at designe ultralyse fluorescerende faste farvestofferNår det kommer til at designe ultralyse solid-state fluorescerende materialer, kan brobyggede krystaldesign være nøglen til at muliggøre monomer emission og få adgang til nye krystallinske systemer, a -
 Syntetisering af værdifulde kemikalier fra forurenet jordKredit:Unsplash/CC0 Public Domain Forskere ved Johannes Gutenberg University Mainz (JGU) og ETH Zürich har udviklet en proces til at producere råvarekemikalier på en meget mindre farlig måde, end
Syntetisering af værdifulde kemikalier fra forurenet jordKredit:Unsplash/CC0 Public Domain Forskere ved Johannes Gutenberg University Mainz (JGU) og ETH Zürich har udviklet en proces til at producere råvarekemikalier på en meget mindre farlig måde, end -
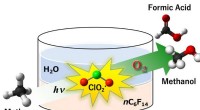 En radikal tilgang til metanoxidation til methanolFig.1:Chlordioxidradikal (ClO2 •) viste sig at virke som et effektivt oxidationsmiddel i den aerobe oxygenering af methan til methanol og myresyre under fotobestråling. Udbyttet af methanol og myresyr
En radikal tilgang til metanoxidation til methanolFig.1:Chlordioxidradikal (ClO2 •) viste sig at virke som et effektivt oxidationsmiddel i den aerobe oxygenering af methan til methanol og myresyre under fotobestråling. Udbyttet af methanol og myresyr -
 Multifunktionel katalysator til giftbestandige brintbrændselscellerReaktionsmekanisme med katalysator til brændselsceller, der bruger brint og kulilte som brændstof. Kredit:Kyushu University Efterspørgslen efter miljøvenlige brændstofkilder er stigende, efterhånd
Multifunktionel katalysator til giftbestandige brintbrændselscellerReaktionsmekanisme med katalysator til brændselsceller, der bruger brint og kulilte som brændstof. Kredit:Kyushu University Efterspørgslen efter miljøvenlige brændstofkilder er stigende, efterhånd
- Hvorfor dyrlæger ordinerer bestemte diæter til kæledyr
- Hvilken type landform udvikler sig ved pladegrænser, hvor den ene oceanisk falder ned under den and…
- Hvor er det bedste sted at se kræftkonstellationen?
- I hvilket forhold er hydrogen- og iltatomer i smørsyrer?
- Hvad er 55 West Latitude og 60 North LongitudeCounty?
- Visa, MasterCard... DNA-kort:Hvad har du i din pung?


