Hvorfor er catenationsevne højest for carbonatomer?
1. Lille atomstørrelse: Carbonatomer er relativt små, hvilket giver dem mulighed for at danne stærke kovalente bindinger med hinanden. Denne stramme binding er vigtig for at danne lange kæder.
2. Stærk C-C-obligation: Carbon danner meget stærk enkelt-, dobbelt- og tredobbeltbindinger med sig selv. Denne styrke bidrager til stabiliteten af lange kulstofkæder.
3. Tetravalency: Carbon har fire valenselektroner, hvilket gør det muligt for det at danne fire kovalente bindinger. Dette muliggør forgrening og komplekse tredimensionelle strukturer.
4. Evne til at danne stabile bindinger med andre elementer: Carbon kan danne stærke bindinger med brint, ilt, nitrogen og andre elementer, hvilket fører til en lang række organiske forbindelser.
5. Mangel på D-orbitaler: I modsætning til tungere elementer i den samme gruppe har Carbon ikke tilgængelige D-orbitaler. Dette forhindrer dannelse af mere end fire bindinger, hvilket bidrager til stabiliteten af kulstofkæder.
Sammenligning med andre elementer:
* silicium: Silicon, mens den også er i gruppe 14, har svagere Si-Si-bindinger og større atomstørrelse, hvilket gør den mindre tilbøjelig til at katte.
* Andre elementer: Andre elementer, såsom ilt, nitrogen og fosfor, har begrænsede catenationsevner på grund af deres tendens til at danne flere bindinger med sig selv, hvilket fører til ustabile kædestrukturer.
Kortfattet:
Kombinationen af lille størrelse, stærke C-C-bindinger, tetravalens og manglen på D-orbitaler gør kulstof unikt egnet til at danne lange, stabile kæder og komplekse strukturer, hvilket giver den den højeste katenationsevne blandt alle elementer. Denne evne er grundlaget for organisk kemi og den forskellige verden af kulstofbaserede molekyler.
 Varme artikler
Varme artikler
-
 Løsning af problemet med kirurgisk rustfrit stålKredit:University of Montreal Rustfrit stål bruges meget i kirurgisk medicin:til medicinsk udstyr, såsom koronarstenter, hofteimplantatstængler og udskiftning af rygmarvsskive, og til en række for
Løsning af problemet med kirurgisk rustfrit stålKredit:University of Montreal Rustfrit stål bruges meget i kirurgisk medicin:til medicinsk udstyr, såsom koronarstenter, hofteimplantatstængler og udskiftning af rygmarvsskive, og til en række for -
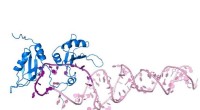 Ny indsigt i modning af miRNA'erForfatterne var i stand til at vise nøjagtigt, hvordan et specifikt RNA-bindende protein (blåt) genkender pri-miR-18a (pink) og ændrer dets struktur på en sådan måde, at det udvikler sig til modent mi
Ny indsigt i modning af miRNA'erForfatterne var i stand til at vise nøjagtigt, hvordan et specifikt RNA-bindende protein (blåt) genkender pri-miR-18a (pink) og ændrer dets struktur på en sådan måde, at det udvikler sig til modent mi -
 Vibration kun i én retningDet nydesignede materiale. Den transmitterer vibrationer fra venstre mod højre, men ikke fra højre mod venstre. Kredit:UvA/Brandenbourger et al. Elektroniske komponenter såsom transistorer transmi
Vibration kun i én retningDet nydesignede materiale. Den transmitterer vibrationer fra venstre mod højre, men ikke fra højre mod venstre. Kredit:UvA/Brandenbourger et al. Elektroniske komponenter såsom transistorer transmi -
 Kemikere designer hurtigere produktionsproces for essentielle sukkerarterKredit:CC0 Public Domain Celler fra alle levende organismer er dækket af et tæt lag af meget komplekse kulhydrater. Disse kulhydrater, som også er kendt som glykaner, er væsentlige mediatorer af e
Kemikere designer hurtigere produktionsproces for essentielle sukkerarterKredit:CC0 Public Domain Celler fra alle levende organismer er dækket af et tæt lag af meget komplekse kulhydrater. Disse kulhydrater, som også er kendt som glykaner, er væsentlige mediatorer af e
- Webværktøj skabt af forskere hjælper med at forudsige klimaændringer i landbruget
- Ny efterforskningsmetode for geotermisk energi
- Hvilke egenskaber har til samme ting som lithium?
- Forskere finder retning, der bestemmes af hastigheden af møntvending i kvanteverdenen
- Hvem var de amerikanske astronauter, der først satte deres fod på månen?
- Hvordan en skovbrand genoprettede et Yosemite-vandskel


