Hvad sker der, når du tilsætter en jern III -nitrat -aq -opløsning til kobber?
1. Kobberopløsning: Kobbermetal (Cu) oxideres til kobber (II) -ioner (Cu²⁺).
2. jern (III) -ioner reduceres: Jern (III) -ioner (Fe³⁺) fra opløsningen reduceres til jern (II) -ioner (Fe²⁺).
3. farveændring: Løsningen vil ændre farve fra en lysegul (på grund af fe³⁺) til en lysegrøn (på grund af fe²⁺).
4. Dannelse af et brun-rødt fast stof: En brun-rød fast, kobber (II) nitrat (Cu (No₃) ₂) kan udfælde ud af opløsningen, afhængigt af koncentrationen af reaktanterne.
Her er den afbalancerede kemiske ligning for reaktionen:
2Fe³⁺ (aq) + cu (s) → 2Fe²⁺ (aq) + cu²⁺ (aq)
Forklaring:
* Kobber er mere reaktiv end jern, hvilket betyder, at det mister elektroner lettere. Dette gør det til et godt reduktionsmiddel, der donerer elektroner til jern (III) -ioner.
* Iron (III) -ioner er et godt oxidationsmiddel, der accepterer elektroner fra kobberet.
Reaktionen opstår, fordi kobberatomerne er mere tilbøjelige til at miste elektroner og blive cu²⁺ioner end Fe³⁺ionen i opløsning. Dette skaber en gunstig energiændring og driver reaktionen fremad.
Sammenfattende resulterer tilsætning af jern (III) nitrat til kobber i en redoxreaktion, hvor kobber oxideres og jern (III) reduceres, hvilket producerer en farveændring og potentielt et fast bundfald.
Sidste artikelHvorfor findes svovldioxid i udstødningsgas?
Næste artikelHvilken rolle spiller vand i absorption af mineralsalte fra jorden?
 Varme artikler
Varme artikler
-
 En saltopløsning til afsaltning af saltlageKredit:Pixabay/CC0 Public Domain Solcelledrevet saltlagekrystallisering kan afhjælpe miljøpåvirkningerne fra afsaltning af havvand. Behandling af spildlage ved hjælp af en selvrensende krystallis
En saltopløsning til afsaltning af saltlageKredit:Pixabay/CC0 Public Domain Solcelledrevet saltlagekrystallisering kan afhjælpe miljøpåvirkningerne fra afsaltning af havvand. Behandling af spildlage ved hjælp af en selvrensende krystallis -
 Fødevareingrediensblandinger mere følsomme over for klimaændringer, undersøgelse finderMauers laboratorieforskning afslører, at fugtsorption i fødevareblandinger er mere følsomme over for klimaændringer end enkelte ingredienser. Kredit:Purdue Department of Food Science foto En nylig
Fødevareingrediensblandinger mere følsomme over for klimaændringer, undersøgelse finderMauers laboratorieforskning afslører, at fugtsorption i fødevareblandinger er mere følsomme over for klimaændringer end enkelte ingredienser. Kredit:Purdue Department of Food Science foto En nylig -
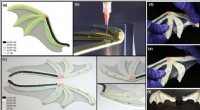 Forskere bryder ny vej inden for 3D-printet blød robotteknologi med det største udvalg af polymerh…(a) Illustration af det strukturelle design. (b) Direkte blæk-skrivning af hybridstrukturen. (c) Hærdet struktur (areal på ~90 cm 2 per vinge, membrantykkelse ~0,7 mm, total armtykkelse ~3,5 mm). (d
Forskere bryder ny vej inden for 3D-printet blød robotteknologi med det største udvalg af polymerh…(a) Illustration af det strukturelle design. (b) Direkte blæk-skrivning af hybridstrukturen. (c) Hærdet struktur (areal på ~90 cm 2 per vinge, membrantykkelse ~0,7 mm, total armtykkelse ~3,5 mm). (d -
 Betydningen af vand i en lovende biomarkør mod kræftEmilio J. Cocinero, medlem af UPV/EHUs Institut for Fysisk Kemi og Biofisika Institute har samarbejdet med Francisco Corzana fra University of La Rioja, og Ramón Hurtado fra ARAID Foundation. Kredit:E
Betydningen af vand i en lovende biomarkør mod kræftEmilio J. Cocinero, medlem af UPV/EHUs Institut for Fysisk Kemi og Biofisika Institute har samarbejdet med Francisco Corzana fra University of La Rioja, og Ramón Hurtado fra ARAID Foundation. Kredit:E
- Hvad er studiet af alle fysiske ting hinsides planeten jorden?
- NASA afslører en bæredygtig kampagne for at vende tilbage til månen, videre til Mars
- Tre nye Beta Cephei-stjerner fundet
- Hvad kan der ske, hvis du ser på solen under en solformørkelse?
- Kan du se solnedgang og måneopgang på samme tid?
- Plasmaforskere udvikler computerprogrammer, der kan reducere omkostningerne ved mikrochips, stimuler…


