Hvad er formlen til saltopløsning?
Sådan forstår du saltopløsninger og deres formler:
Forståelse af saltopløsninger
* salt: "Salt" er en generel betegnelse for en forbindelse dannet af en reaktion mellem en syre og en base. Almindelig bordsalt (NaCl) er kun et eksempel. Andre salte inkluderer kaliumchlorid (KCL), magnesiumsulfat (MGSO4) osv.
* Løsning: En opløsning er en homogen blanding, hvor et stof (opløsningen) opløses jævnt i et andet (opløsningsmidlet).
* saltopløsning: En saltopløsning er simpelthen en opløsning, hvor et salt er opløst stof og vand normalt er opløsningsmidlet.
Formler og koncentrationer
For at beskrive en saltopløsning skal du specificere følgende:
* type salt: For eksempel NaCl, KCL osv.
* Koncentration: Hvor meget salt opløses i en given mængde opløsningsmiddel. Koncentration kan udtrykkes på forskellige måder, herunder:
* Molaritet (M): Mol opløst stof pr. Liter opløsning.
* Procentdel (w/v): Vægt af opløst stof pr. Volumen opløsning (f.eks. Gram salt pr. 100 ml opløsning).
* dele pr. million (ppm): Masse af opløst stof pr. Million dele af opløsningen.
Eksempel:
* a 1 m opløsning af NaCl: Dette betyder, at der er 1 mol natriumchlorid (NaCl) opløst i hver 1 liter opløsning.
* en 5% (w/v) løsning af KCL: Dette betyder, at der er 5 gram kaliumchlorid (KCL) opløst i hver 100 ml opløsning.
Forberedelse af saltopløsninger
For at forberede en saltopløsning skal du:
1. Kend det ønskede salt og dens molekylvægt.
2. Beregn den krævede masse salt
3. Opløs saltet i et specifikt volumen vand.
Vigtige noter:
* opløselighed: Ikke alle salte opløses lige så godt i vand. Nogle salte er meget opløselige, mens andre kun er lidt opløselige.
* sikkerhed: Når du arbejder med saltopløsninger, skal du altid bære passende sikkerhedsudstyr (handsker, beskyttelsesbriller) og håndtere kemikalier omhyggeligt.
Fortæl mig, hvis du har et specifikt salt i tankerne, og jeg kan hjælpe dig med at beregne formlen for en bestemt opløsning.
 Varme artikler
Varme artikler
-
 Gør en almindelig plast til molekyler af høj værdiEn simpel one-pot proces gør polyethylenplastaffald til værdifulde væsker, når det udsættes for en fast kemisk katalysator og lidt varme. Kredit:Fan Zhang, UCSB, CC BY-SA Hvis du troede, at de spi
Gør en almindelig plast til molekyler af høj værdiEn simpel one-pot proces gør polyethylenplastaffald til værdifulde væsker, når det udsættes for en fast kemisk katalysator og lidt varme. Kredit:Fan Zhang, UCSB, CC BY-SA Hvis du troede, at de spi -
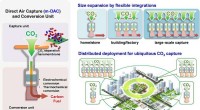 Membraner til at opfange kuldioxid fra luftenTeknologiske løsninger for CO2-emissionen til atmosfæren bør omfatte forskellige tilgange, da der ikke findes én silver bullet-løsning. I dette arbejde, forskere fra I2CNER, Kyushu University og NanoM
Membraner til at opfange kuldioxid fra luftenTeknologiske løsninger for CO2-emissionen til atmosfæren bør omfatte forskellige tilgange, da der ikke findes én silver bullet-løsning. I dette arbejde, forskere fra I2CNER, Kyushu University og NanoM -
 Ingeniører finder, at antioxidanter forbedrer nanoskala visualisering af polymererTilføjelse af antioxidanter kan skubbe opløsningsgrænsen for polymerelektronmikroskopi for at afsløre en struktur, der er mindre i skala (blå) sammenlignet med den struktur, der tidligere er observere
Ingeniører finder, at antioxidanter forbedrer nanoskala visualisering af polymererTilføjelse af antioxidanter kan skubbe opløsningsgrænsen for polymerelektronmikroskopi for at afsløre en struktur, der er mindre i skala (blå) sammenlignet med den struktur, der tidligere er observere -
 Dyrkning af polymerer med forskellige længderSymbolsk repræsentation af, hvordan spredningen af et plastik kan kontrolleres ved at blande to katalysatorer (malerør). Kredit:Whitfield R et al, Chem, 2020 ETH-forskere har udviklet en ny meto
Dyrkning af polymerer med forskellige længderSymbolsk repræsentation af, hvordan spredningen af et plastik kan kontrolleres ved at blande to katalysatorer (malerør). Kredit:Whitfield R et al, Chem, 2020 ETH-forskere har udviklet en ny meto


