I neutrale molekyler dannes hvor mange bindinger ofte af nitrogen og separat ilt?
* nitrogen (n): Nitrogen danner typisk tre kovalente bindinger . Dette skyldes, at det har fem valenselektroner og har brug for tre mere for at opnå en stabil octet -konfiguration. Eksempler inkluderer ammoniak (NH3) og nitrogengas (N2).
* ilt (O): Oxygen danner typisk to kovalente bindinger . Det har seks valenselektroner og har brug for to mere for at afslutte sin oktet. Eksempler inkluderer vand (H2O) og iltgas (O2).
Vigtig note: Selvom dette er de mest almindelige bindingsmønstre, er der nogle undtagelser, såsom dannelse af nitrogenoxider (NOX), hvor nitrogen kan danne forskellige antal bindinger.
Sidste artikelEr iltforbindelser eller et atommolekyler?
Næste artikelReact Iron III nitrat og natriumhydroxid?
 Varme artikler
Varme artikler
-
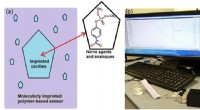 Hurtig påvisning af giftige forbindelserFigur viser (a) princippet for MIP-baserede sensorer, hvor unikke mønstre af målmolekylerne er præget på en polymerbaseret sensorfilm og (b) et eksperiment udføres ved hjælp af den MIP-baserede sensor
Hurtig påvisning af giftige forbindelserFigur viser (a) princippet for MIP-baserede sensorer, hvor unikke mønstre af målmolekylerne er præget på en polymerbaseret sensorfilm og (b) et eksperiment udføres ved hjælp af den MIP-baserede sensor -
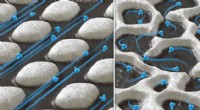 Kører vand ned ad nanomotorvejeSkematiske afbildninger af membraner med ordnede (venstre) og uordnede (højre) kanalstrukturer. Kredit:Xavier Pita Fjernelse af vanddamp fra luft og andre gasblandinger, som er afgørende for mange
Kører vand ned ad nanomotorvejeSkematiske afbildninger af membraner med ordnede (venstre) og uordnede (højre) kanalstrukturer. Kredit:Xavier Pita Fjernelse af vanddamp fra luft og andre gasblandinger, som er afgørende for mange -
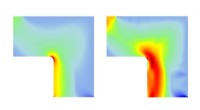 Materialegradienter kunne styrke polymerkomponenterGengivelser af, hvordan belastningen er fordelt på tværs af et L-formet beslag, der udelukkende er lavet af en stiv polymer (venstre) vs. et beslag med både stive og fleksible polymerer (højre). Kredi
Materialegradienter kunne styrke polymerkomponenterGengivelser af, hvordan belastningen er fordelt på tværs af et L-formet beslag, der udelukkende er lavet af en stiv polymer (venstre) vs. et beslag med både stive og fleksible polymerer (højre). Kredi -
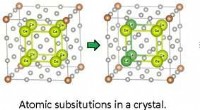 Udnyttelse af symmetrier:Fremskynder beregningsstudiet af solide løsningerGrafisk abstrakt. Kredit:Journal of Chemical Information and Modeling (2022). DOI:10.1021/acs.jcim.2c00389 Symmetri er et udbredt træk i naturen på alle skalaer. For eksempel kan vores blotte øjne
Udnyttelse af symmetrier:Fremskynder beregningsstudiet af solide løsningerGrafisk abstrakt. Kredit:Journal of Chemical Information and Modeling (2022). DOI:10.1021/acs.jcim.2c00389 Symmetri er et udbredt træk i naturen på alle skalaer. For eksempel kan vores blotte øjne
- Hvad sker der lige før transskriptionen begynder?
- 1 + 1 er ikke lig med 2 for grafenlignende 2-D materialer
- Forskere udvikler en ny tilgang til polarisationsuafhængig LC-fasemodulering
- Hvorfor elefanter har knurhår på deres snabel
- Hvad kaldes en varm væske?
- Eksotisk liv hinsides Jorden? Leder efter, da vi ikke kender det


