Hvad har det højere smeltepunkt natriumchlorid eller aluminiumoxid?
* ionisk bindingsstyrke: Begge forbindelser er ioniske, hvilket betyder, at de holdes sammen af elektrostatiske attraktioner mellem positivt ladede ioner (kationer) og negativt ladede ioner (anioner).
* aluminiumoxid: Aluminium har en +3 ladning, og ilt har en -2 -ladning, hvilket fører til en stærk elektrostatisk attraktion.
* natriumchlorid: Natrium har en +1 ladning, og klor har en -1 -ladning, hvilket resulterer i en svagere elektrostatisk attraktion sammenlignet med aluminiumoxid.
* gitterstruktur: Arrangementet af ioner i et krystalgitter spiller også en rolle. Aluminiumoxid har en mere tæt pakket og stabil krystalstruktur end natriumchlorid, hvilket gør det sværere at bryde fra hinanden.
smeltepunkter:
* aluminiumoxid (al₂o₃): ~ 2072 ° C (3761 ° F)
* natriumchlorid (NaCl): ~ 801 ° C (1474 ° F)
Det markant højere smeltepunkt for aluminiumoxid er en direkte konsekvens af dets stærkere ioniske bindinger og mere stabil krystalstruktur.
 Varme artikler
Varme artikler
-
 Super-adsorberende MOF fanger dobbelt så meget i vandDenne figur viser strukturen Hydrolytisk stabil og meget porøs Cr-soc-MOF-1, som kan fange dobbelt sin vægt i adsorberet vand. Kredit:Prof.Mohamed Eddaoudi (KAUST) Materialekemikere i Kongeriget S
Super-adsorberende MOF fanger dobbelt så meget i vandDenne figur viser strukturen Hydrolytisk stabil og meget porøs Cr-soc-MOF-1, som kan fange dobbelt sin vægt i adsorberet vand. Kredit:Prof.Mohamed Eddaoudi (KAUST) Materialekemikere i Kongeriget S -
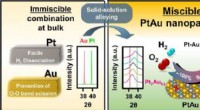 Direkte syntese af hydrogenperoxid med en platin-guld nanopartikelkatalysatorGuld-platin nanopartikel komposit skematisk. Kredit:Korea Institute of Science and Technology (KIST) Hydrogenperoxid fortyndet i vand bruges som desinfektionsmiddel til behandling af sår. Det er m
Direkte syntese af hydrogenperoxid med en platin-guld nanopartikelkatalysatorGuld-platin nanopartikel komposit skematisk. Kredit:Korea Institute of Science and Technology (KIST) Hydrogenperoxid fortyndet i vand bruges som desinfektionsmiddel til behandling af sår. Det er m -
 Stive fibre spundet af slimSlankt jagtvåben:fløjlsorm, der ligner larver med korte ben, fange bytte med en sekretion, der danner polymertråde, mens byttet kæmper for at frigøre sig selv. Kredit:Alexander Bär / Nature Communicat
Stive fibre spundet af slimSlankt jagtvåben:fløjlsorm, der ligner larver med korte ben, fange bytte med en sekretion, der danner polymertråde, mens byttet kæmper for at frigøre sig selv. Kredit:Alexander Bär / Nature Communicat -
 Forskere udforsker brugen af nye materialer til at skabe mere effektive solcellerPostdoc-forsker Sarah Wieghold og adjunkt Lea Nienhaus leder efter måder at skabe bedre solceller, der kan bruge infrarødt lys. Kredit:Florida State University Et team af forskere fra Florida Stat
Forskere udforsker brugen af nye materialer til at skabe mere effektive solcellerPostdoc-forsker Sarah Wieghold og adjunkt Lea Nienhaus leder efter måder at skabe bedre solceller, der kan bruge infrarødt lys. Kredit:Florida State University Et team af forskere fra Florida Stat
- OS, EU sparrer med at dele elektronisk bevismateriale i efterforskninger
- Hvordan en celles mitokondrier laver deres egne proteinfabrikker
- Hvilken struktur er ansvarlig for at producere nye molekyler?
- Hvad mener jeg i videnskaben?
- Sådan kontrolleres en transistor med en digital MultiMeter
- 58 døde, redningsfolk i dag og nat jager forsvundne efter tyfonen i Japan


