Hvad er den molære masse af ammoniumchromat NH4 2CRO4?
1. Identificer elementerne og deres atommasser
* nitrogen (n): 14,01 g/mol
* brint (H): 1,01 g/mol
* krom (CR): 52,00 g/mol
* ilt (O): 16,00 g/mol
2. Tæl antallet af atomer i hvert element
* nitrogen (n): 2
* brint (H): 8
* krom (CR): 1
* ilt (O): 4
3. Beregn den samlede masse
(2 x 14,01 g/mol) + (8 x 1,01 g/mol) + (1 x 52,00 g/mol) + (4 x 16,00 g/mol) = 152,04 g/mol
Derfor er den molære masse af ammoniumchromat ((NH₄) ₂cro₄) 152,04 g/mol.
Sidste artikelHvad er massen for aluminiumschloratformel?
Næste artikelHvad er forskellen mellem jernsulfat og Ferrex 150?
 Varme artikler
Varme artikler
-
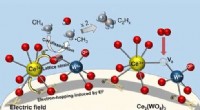 Ny, lavprisalternativ til ethylenproduktionReaktionsmekanismer for den oxidative kobling af methan (OCM) over Ce2(WO4)3-katalysatorer ved lave temperaturer i et elektrisk felt. Kredit:Waseda University Det øgede udbud og de optimerede omko
Ny, lavprisalternativ til ethylenproduktionReaktionsmekanismer for den oxidative kobling af methan (OCM) over Ce2(WO4)3-katalysatorer ved lave temperaturer i et elektrisk felt. Kredit:Waseda University Det øgede udbud og de optimerede omko -
 Forskere løser en materialemysternøgle til næste generations elektroniske enhederMaterialevidenskab og teknik postdoktorforsker Hyungwoo Lee kigger inde i et tyndfilmsdepositionssystem under vækst af oxid tyndfilmstruktur. Kredit:Renee Meiller Lennon og McCartney. Abbott og Co
Forskere løser en materialemysternøgle til næste generations elektroniske enhederMaterialevidenskab og teknik postdoktorforsker Hyungwoo Lee kigger inde i et tyndfilmsdepositionssystem under vækst af oxid tyndfilmstruktur. Kredit:Renee Meiller Lennon og McCartney. Abbott og Co -
 Gør ammoniak grønnereGrafisk illustration, der viser protoneret vand, der reagerer med nitrogenmolekyler for at danne ammoniak ved en plasma-væske-grænseflade. Kredit:Case Western Reserve University Ammoniak, en forbi
Gør ammoniak grønnereGrafisk illustration, der viser protoneret vand, der reagerer med nitrogenmolekyler for at danne ammoniak ved en plasma-væske-grænseflade. Kredit:Case Western Reserve University Ammoniak, en forbi -
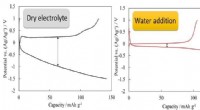 Elektrolyttens struktur styrer batteriets ydeevneVi har fundet ud af, at tilsætning af vand i høj grad reducerer forskellen i spænding (overspænding) mellem opladning/afladning. Kredit:COPYRIGHT (C) TOYOHASHI UNIVERSITY OF TECHNOLOGY. Forskerhol
Elektrolyttens struktur styrer batteriets ydeevneVi har fundet ud af, at tilsætning af vand i høj grad reducerer forskellen i spænding (overspænding) mellem opladning/afladning. Kredit:COPYRIGHT (C) TOYOHASHI UNIVERSITY OF TECHNOLOGY. Forskerhol
- Hvorfor ligner gamle par hinanden?
- Undersøgelse undersøger, hvordan herbicid øger fosforniveauet i jord og vandveje
- Hvad vi ved om, hvordan 'for evigt kemikalier' påvirker sundheden
- Er der 4 indre planeter i solsystemet?
- Giv et eksempel på ikke-levende ting, der giver to egenskaber levende ting?
- Hvilke organismer deler sig ved spaltning Furrow?


