Valence lithium natrium reagerer de på lignende måder?
Ligheder:
* Høj reaktivitet: Både lithium og natrium er meget reaktive metaller og reagerer let med vand, ilt og andre elementer.
* Dannelse af ioner: Begge elementer har en tendens til at miste et elektron til dannelse af en +1 -kation (Li+og Na+).
* Dannelse af salte: De danner salte med forskellige anioner, såsom halogenider, sulfater og carbonater.
Forskelle:
* reaktivitet med vand: Lithium reagerer langsommere med vand end natrium. Natrium reagerer kraftigt og eksplosivt med vand, mens lithium reagerer mere forsigtigt og producerer brintgas.
* reaktivitet med ilt: Lithium danner lithiumoxid (Li₂O), når den udsættes for luft, mens natrium danner natriumoxid (Na₂O) og natriumperoxid (Na₂O₂).
* smelte- og kogepunkter: Lithium har et højere smeltepunkt og kogepunkt end natrium.
* densitet: Natrium er mindre tæt end lithium, hvilket betyder, at det er lettere.
* flammefarve: Når det brændes, producerer lithium en crimson rød flamme, mens natrium producerer en lysegul flamme.
Kortfattet: Mens lithium og natrium deler nogle lignende kemiske egenskaber, adskiller deres reaktivitet og andre egenskaber sig markant. Disse forskelle opstår fra deres forskellige elektronkonfigurationer og atomstørrelser.
Bemærk: Det er vigtigt at håndtere både lithium og natrium med ekstrem forsigtighed på grund af deres høje reaktivitet og potentiale for brand og eksplosion.
Sidste artikelHvor mange hydrogenatomer er der i 4H2O?
Næste artikelHvilken er stærkere enten palladium på carbon eller palladiumhydroxid?
 Varme artikler
Varme artikler
-
 Forvandling af stamceller til knogler med nanolerforstærket hydrogelKredit:CC0 Public Domain Adjunkt Alireza Dolatshahi-Pirouz og kolleger har udviklet en hydrogel, der kombinerer syntetiske materialer med levende celler, og kan omdanne stamceller til knogler uden
Forvandling af stamceller til knogler med nanolerforstærket hydrogelKredit:CC0 Public Domain Adjunkt Alireza Dolatshahi-Pirouz og kolleger har udviklet en hydrogel, der kombinerer syntetiske materialer med levende celler, og kan omdanne stamceller til knogler uden -
 Går småt for at bestemme, hvor nukleart materiale kom fra, og hvordan det blev lavetIn-situ uran-isotop-billeddannelse af NanoSIMS kan give indsigt i proceshistorien og oprindelsen af materialer til nukleare brændstofpellets til støtte for nuklear retsmedicinske undersøgelser. Kred
Går småt for at bestemme, hvor nukleart materiale kom fra, og hvordan det blev lavetIn-situ uran-isotop-billeddannelse af NanoSIMS kan give indsigt i proceshistorien og oprindelsen af materialer til nukleare brændstofpellets til støtte for nuklear retsmedicinske undersøgelser. Kred -
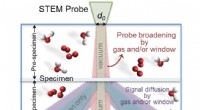 Bestemmelse af parametrene for transmissionselektronmikroskopiGaseffekter på spredning af hurtige elektroner, der bidrager til ESTEM -sonden og signalet. Kredit:Pacific Northwest National Laboratory Selvom telefonerne i vores lommer måske er perfekte til at
Bestemmelse af parametrene for transmissionselektronmikroskopiGaseffekter på spredning af hurtige elektroner, der bidrager til ESTEM -sonden og signalet. Kredit:Pacific Northwest National Laboratory Selvom telefonerne i vores lommer måske er perfekte til at -
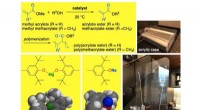 Industriel forbindelse får en miljøvenlig reaktionNatrium- eller magnesiumaryloxider kan katalysere transesterificeringen af methyl(meth)acrylat ved stuetemperatur, med høj kemoselektivitet, producerer et højt udbytte af (meth) acrylatester, og ude
Industriel forbindelse får en miljøvenlig reaktionNatrium- eller magnesiumaryloxider kan katalysere transesterificeringen af methyl(meth)acrylat ved stuetemperatur, med høj kemoselektivitet, producerer et højt udbytte af (meth) acrylatester, og ude
- Hvad er kræfter, der bevæger sig i modsatte retninger, er ikke en fequal styrke?
- Sådan fungerer pistolskabe
- Hvilke typer klipper bevæger sig gennem klippecyklussen?
- Spiderweb som inspiration til at skabe en af verdens mest præcise mikrochipsensorer
- Løsning af pandekageproblemet
- Hvordan dannes mikrovilli?


