Hvordan dannes ioniske forbindelser?
1. Overførsel af elektroner:
- metaller har en tendens til at miste elektroner og danne positivt ladede ioner (kationer).
- ikke -metaller har en tendens til at vinde elektroner og danne negativt ladede ioner (anioner).
2. Elektrostatisk tiltrækning:
- De modsatte ladede ioner tiltrækker hinanden stærkt og danner en ionisk binding. Denne attraktion er det, der holder ionerne sammen i en krystalgitterstruktur.
3. Krystalgitterdannelse:
- Ionerne arrangerer sig i en meget ordnet, tredimensionel struktur kaldet en krystalgitter. Denne struktur er et resultat af at minimere den elektrostatiske frastødning mellem ioner af samme ladning og maksimere tiltrækningen mellem modsat ladede ioner.
Eksempel:
Lad os overveje dannelsen af natriumchlorid (NaCl), almindeligt bordsalt:
- natrium (NA) , et metal, mister et elektron for at blive en natriumion (Na +) med en +1 ladning.
- klor (CL) , en ikke -metal, får en elektron til at blive en chloridion (CL-) med en -1 -ladning.
- Na+ og cl- ioner tiltrækkes af hinanden på grund af deres modsatte ladninger og danner en ionisk binding.
- Disse ioner arrangerer sig i en kubisk krystalgitter, hvilket resulterer i den faste, krystallinske struktur af natriumchlorid.
Nøglepunkter:
* ioniske forbindelser dannes mellem metaller og ikke -metaller.
* elektroner overføres fra metallet til ikke -metalet.
* De resulterende ioner holdes sammen af elektrostatiske kræfter.
* ioniske forbindelser har typisk høje smeltepunkter og kogepunkter på grund af den stærke elektrostatiske tiltrækning mellem ioner.
* De er normalt solide ved stuetemperatur og er gode ledere af elektricitet, når de opløses i vand eller smeltet.
Fortæl mig, hvis du gerne vil have flere detaljer om et specifikt aspekt af ionisk sammensat dannelse!
Sidste artikelHvad er den kemiske formel for jern III -carbonat?
Næste artikelHvor mange mol carbon er der i 0,100 dioxid?
 Varme artikler
Varme artikler
-
 Bæredygtige 3D-printede supermagneterPå Graz teknologiske universitet, miniaturiserede supermagneter blev produceret for første gang ved hjælp af laserbaseret 3D-print. Kredit:IMAT – TU Graz Fra vindmøller og elektriske motorer til s
Bæredygtige 3D-printede supermagneterPå Graz teknologiske universitet, miniaturiserede supermagneter blev produceret for første gang ved hjælp af laserbaseret 3D-print. Kredit:IMAT – TU Graz Fra vindmøller og elektriske motorer til s -
 Nyt katalysatormateriale kan forårsage ren energi -revolutionEn tegneserie af katalysatorens struktur. Kredit:Aalto University Brændselsceller og vandelektrolysatorer, der er billige og effektive, vil danne hjørnesten i en brintbrændstofbaseret økonomi, som
Nyt katalysatormateriale kan forårsage ren energi -revolutionEn tegneserie af katalysatorens struktur. Kredit:Aalto University Brændselsceller og vandelektrolysatorer, der er billige og effektive, vil danne hjørnesten i en brintbrændstofbaseret økonomi, som -
 Forskere finder en måde at udnytte hele spektret af sollysForskere har vist, for første gang, at det er muligt at indsamle energi fra hele det synlige spektrum af sollys og transformere det, hurtigt og effektivt, til brint som brændstof. Kredit:David Monje p
Forskere finder en måde at udnytte hele spektret af sollysForskere har vist, for første gang, at det er muligt at indsamle energi fra hele det synlige spektrum af sollys og transformere det, hurtigt og effektivt, til brint som brændstof. Kredit:David Monje p -
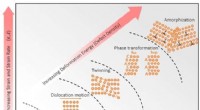 Øer uden struktur inde i metallegeringer kan føre til hårdere materialerForeslået hierarkisk deformationsmekanisme-paradigme for de ækviatomiske CrCoNi-baserede HEAer udsat for stigende grader af deformation. Elastisk deformation, dislokationsmedieret plasticitet, twinnin
Øer uden struktur inde i metallegeringer kan føre til hårdere materialerForeslået hierarkisk deformationsmekanisme-paradigme for de ækviatomiske CrCoNi-baserede HEAer udsat for stigende grader af deformation. Elastisk deformation, dislokationsmedieret plasticitet, twinnin
- Hvad er oxidationstilstanden for CLO?
- Hvordan simuleringer kunne hjælpe med at få PFAS ud af jorden
- Forskere beskriver de første hybridfuglearter nogensinde fra Amazonas
- Hvad sker der, når vand skifter fra en væske til gas?
- Overraskende fund om skovbrande
- Salater i rummet? Astronauter prøver at dyrke egne grøntsager


