Hvordan tror du, at smeltepunktet med saltvand sammenlignes med det rene vand?
* frysningspunktdepression: Når du opløser et opløst stof (som salt) i et opløsningsmiddel (som vand), forstyrrer det dannelsen af den almindelige krystalstruktur, som vandmolekyler dannes ved frysning. Denne forstyrrelse gør det sværere for vandet at størkne ved det sædvanlige frysepunkt.
* Kolligativ egenskab: Frysningspunktdepression er en colligativ egenskab, hvilket betyder, at den afhænger af koncentrationen af opløstelsen, ikke dens specifikke identitet. Jo mere salt du opløses, jo lavere vil frysningspunktet være.
i enklere termer: Salt forstyrrer processen med vandmolekyler, der låser sig sammen i is, så vandet skal være koldere for at fryse.
Sidste artikelHvad er den afbalancerede ligning for anilin med jernchlorid?
Næste artikelHvordan bliver flydende nitrogen flydende?
 Varme artikler
Varme artikler
-
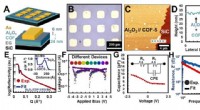 Forskere hjælper med at holde trit med Moores Law ved at udforske en ny materialeklasseImpedansmålinger udført på parallelle pladekondensatorer bekræfter, at COF-5 er et lav-k dielektrikum. Kredit:Austin Evans Fremskridt inden for integrerede kredsløb måles ved at matche, overstiger
Forskere hjælper med at holde trit med Moores Law ved at udforske en ny materialeklasseImpedansmålinger udført på parallelle pladekondensatorer bekræfter, at COF-5 er et lav-k dielektrikum. Kredit:Austin Evans Fremskridt inden for integrerede kredsløb måles ved at matche, overstiger -
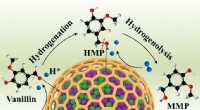 Indkapslede NiCo -legering nanopartikler, der katalyserer HDO -reaktionerEn indkapslet bimetallisk Ni-Co-legeringsstrategi er innovativt designet til at forbedre hydrodeoxygeneringsydelsen af biomassederivater til de tilsvarende methylerede produkter i vand. Kredit:Chine
Indkapslede NiCo -legering nanopartikler, der katalyserer HDO -reaktionerEn indkapslet bimetallisk Ni-Co-legeringsstrategi er innovativt designet til at forbedre hydrodeoxygeneringsydelsen af biomassederivater til de tilsvarende methylerede produkter i vand. Kredit:Chine -
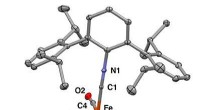 Ustabile molekyleklik med syntetisk strategiRøntgenkrystalstruktur af det mononukleære jern η2-diphosphorkompleks. Kredit:Figueroa Lab Group, UC San Diego / Curtis Moore, Ohio State University Grundstofferne i det periodiske system af grunds
Ustabile molekyleklik med syntetisk strategiRøntgenkrystalstruktur af det mononukleære jern η2-diphosphorkompleks. Kredit:Figueroa Lab Group, UC San Diego / Curtis Moore, Ohio State University Grundstofferne i det periodiske system af grunds -
 Blå-emitterende diode demonstrerer begrænsninger og løfter om perovskit-halvledereUC Berkeley kemikere skabte en type halogenid perovskit krystal, der udsender blåt lys, noget der har været svært at opnå med dette trendy nye materiale. Men forskerne opdagede, at disse materialer i
Blå-emitterende diode demonstrerer begrænsninger og løfter om perovskit-halvledereUC Berkeley kemikere skabte en type halogenid perovskit krystal, der udsender blåt lys, noget der har været svært at opnå med dette trendy nye materiale. Men forskerne opdagede, at disse materialer i
- Hvordan forskere bruger spektre til at bestemme sammensætningen af stjerner?
- Hvorfor brugte grækerne ordplanet til at beskrive usædvanlige stjerner på himlen?
- Sådan bruges et Tasco Luminova Teleskop
- Hawaii vulkan frigiver flere små eksplosioner, slangende lava
- Hvad er antallet af atomer i FCC-enhedscellen?
- Hvad er forskellen på en arktisk tundra og en alpin tundra?


