Hvad er den kemiske formel for ionisk forbindelse dannet af aluminium og svovl?
1. Identificer afgifterne for ionerne:
* Aluminium (AL) er i gruppe 3A, så den danner en +3 ion (al³⁺).
* Svovl (er) er i gruppe 6A, så det danner en -2 ion (s²⁻).
2. Find de mindst almindelige multiple (LCM) af afgifterne:
* LCM på 3 og 2 er 6.
3. Bestem underskrifterne:
* For at opnå en +6 ladning har vi brug for to aluminiumioner (2 x +3 =+6).
* For at opnå en -6 -ladning har vi brug for tre svovlioner (3 x -2 =-6).
4. Skriv formlen:
Den kemiske formel for den ioniske forbindelse er al₂s₃ .
Sidste artikelHvor mange atomer er der i BASO3?
Næste artikelEr en kobberrørforbindelse eller blanding?
 Varme artikler
Varme artikler
-
 Forskere opdager, at molekyler spin flip fra magnetiske til ikke-magnetiske former dynamiskKredit:University of Missouri-Columbia En uventet opdagelse i professor Arthur Suits kemilaboratorium kunne få konsekvenser for fremstilling af mere effektive solceller og forbedring af fotodynami
Forskere opdager, at molekyler spin flip fra magnetiske til ikke-magnetiske former dynamiskKredit:University of Missouri-Columbia En uventet opdagelse i professor Arthur Suits kemilaboratorium kunne få konsekvenser for fremstilling af mere effektive solceller og forbedring af fotodynami -
 Video:Chemtrails vs. contrailsKredit:The American Chemical Society Det er let at se på det hvide spor bag et jetfly og forestille sig alle former for kemikalier, der regner ned ovenfra. Imidlertid, flyindstyr er simpelthen det
Video:Chemtrails vs. contrailsKredit:The American Chemical Society Det er let at se på det hvide spor bag et jetfly og forestille sig alle former for kemikalier, der regner ned ovenfra. Imidlertid, flyindstyr er simpelthen det -
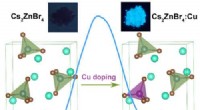 Metode til udvikling af blåemitterende nul-dimensionelle uorganiske metalhalogeniderDoping af Cu+ til 0D Cs 2 ZnBr 4 forårsagede en tydelig excitonisk absorptionstop, og med succes transformeret det svagt selvlysende Cs 2 ZnBr 4 til et klart blåt emitterende materiale med høj
Metode til udvikling af blåemitterende nul-dimensionelle uorganiske metalhalogeniderDoping af Cu+ til 0D Cs 2 ZnBr 4 forårsagede en tydelig excitonisk absorptionstop, og med succes transformeret det svagt selvlysende Cs 2 ZnBr 4 til et klart blåt emitterende materiale med høj -
 Fuldt identificeret - protonernes vejMartin Winkler, Jifu Duan og Thomas Happe (fra venstre) sporede protonernes vej helt ind i det aktive center af hydrogenaser. Kredit:RUB, Marquard I deres katalytiske center, hydrogenaser fremstil
Fuldt identificeret - protonernes vejMartin Winkler, Jifu Duan og Thomas Happe (fra venstre) sporede protonernes vej helt ind i det aktive center af hydrogenaser. Kredit:RUB, Marquard I deres katalytiske center, hydrogenaser fremstil
- Hvorfor rammer 3 sfæriske objekt med forskellig masse jorden på samme tid, når det droppes samtid…
- Har Jupiter en atmosfære, hvis ja, hvad er sammensætningen af atmosfære?
- Hvad sker der med afstand, når en simpel maskine hjælper med at reducere kraft?
- Hvilken mineralprøve efterlader en pulverlinje på pladen?
- Satnav holder øje med rugbyspillere
- Hvad er sukkeret i en blanding af og vand?


