Hvorfor har nitrogen et afgift for negativ 3, når det deltager i kemisk reaktion?
* Elektronisk konfiguration: Nitrogen har 5 valenselektroner (elektroner i dets yderste skal). For at opnå en stabil octet (8 elektroner) skal den få 3 flere elektroner. Denne gevinst af elektroner giver den en negativ ladning.
* Elektronegativitet: Nitrogen er et meget elektronegativt element, hvilket betyder, at det stærkt tiltrækker elektroner. I kovalente bindinger trækker nitrogen ofte elektroner mod sig selv og giver det en delvis negativ ladning.
* ioniske forbindelser: I nogle ioniske forbindelser danner nitrogen anioner med en -3 -ladning (som i nitrider, f.eks. Mg₃n₂).
Det er dog vigtigt at bemærke:
* Oxidation siger: Kvælstof kan udvise forskellige oxidationstilstande (fra -3 til +5) afhængigt af bindingsmiljøet.
* kovalente obligationer: I kovalente bindinger er ladningen på nitrogen ikke en fuld -3, men snarere en delvis negativ ladning på grund af elektronegativitetsforskellen.
Eksempler:
* ammoniak (NH₃): Nitrogen har en formel ladning på -3 i ammoniak, fordi det deler 3 elektroner med de 3 hydrogenatomer.
* salpetersyre (HNO₃): Kvælstof har en oxidationstilstand på +5 i salpetersyre, da det har mistet 5 elektroner.
* nitrogengas (N₂): I den elementære form har nitrogen en oxidationstilstand på 0, da det deler elektroner lige med et andet nitrogenatom.
Konklusion: Mens nitrogen * kan * have en ladning på -3 i visse kemiske reaktioner, er det ikke en universel regel. Anklagen for nitrogen afhænger af det specifikke kemiske miljø og dets bindingspartnere.
 Varme artikler
Varme artikler
-
 Ingeniører opdager blyfri perovskit halvleder til solceller ved hjælp af dataanalyse, supercompute…En atommodel af KBaTeBiO6 (til venstre), den mest lovende af 30, 000 oxider i et potentielt solpanel. Til højre ses et scannings transmissionselektronmikrograf, der viser atomstrukturen af KBaTeBiO6
Ingeniører opdager blyfri perovskit halvleder til solceller ved hjælp af dataanalyse, supercompute…En atommodel af KBaTeBiO6 (til venstre), den mest lovende af 30, 000 oxider i et potentielt solpanel. Til højre ses et scannings transmissionselektronmikrograf, der viser atomstrukturen af KBaTeBiO6 -
 Forskere trykker på lasere for at efterligne hajhud, andre naturlige overfladerCraig Zuhlke (til venstre), en forskningsadjunkt, og Aaron Ediger, en færdiguddannet forskningsassistent, se, hvordan en laser modificerer en lille prøve af metal. Forskningen, ledet af Nebraskas Denn
Forskere trykker på lasere for at efterligne hajhud, andre naturlige overfladerCraig Zuhlke (til venstre), en forskningsadjunkt, og Aaron Ediger, en færdiguddannet forskningsassistent, se, hvordan en laser modificerer en lille prøve af metal. Forskningen, ledet af Nebraskas Denn -
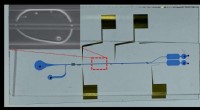 Mikrofluidisk system med celleadskillende kræfter kan afsløre, hvordan nye patogener angriberEt billede af den in-dråbe celleadskillelse mikrofluidisk chip, viser de mikrofluidiske kanaler og elektroder. Forstørret billede viser en værtscelle og patogene bakterieceller, der adskilles til top
Mikrofluidisk system med celleadskillende kræfter kan afsløre, hvordan nye patogener angriberEt billede af den in-dråbe celleadskillelse mikrofluidisk chip, viser de mikrofluidiske kanaler og elektroder. Forstørret billede viser en værtscelle og patogene bakterieceller, der adskilles til top -
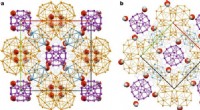 To Frank-Kasper faser i saltkrystalstrukturer observereten, Fase 1. b, Fase 2. Klynger A1, A2, B og C er farvet i lilla, orange, blå og grå, henholdsvis. I begge strukturer, lidelse er blevet fjernet for klarhedens skyld. Chlorider er blevet forbundet for
To Frank-Kasper faser i saltkrystalstrukturer observereten, Fase 1. b, Fase 2. Klynger A1, A2, B og C er farvet i lilla, orange, blå og grå, henholdsvis. I begge strukturer, lidelse er blevet fjernet for klarhedens skyld. Chlorider er blevet forbundet for
- Jordens første atmosfære indeholdt hvilke gasser?
- Hvilke reaktioner er koblet i aerob respiration?
- Hvis den potentielle energi i en sving er 200 j på sit højeste punkt og 50 lavest hvad kinetisk, h…
- Solen brænder hydrogenat et helium for at gøre hvad?
- Hvad er der i dit vand? Forskere identificerer nye giftige biprodukter ved desinficering af drikkeva…
- Forskere designer system til at visualisere objekter gennem skyer og tåge


