Hvorfor skal overskydende ammoniak tilsættes kobberioner opløsning opnår det dybe blå kompleks af tetra -amin?
trin-for-trin-dannelse og hvorfor der er behov for overskydende ammoniak:
1. Første reaktion: Når ammoniak først tilsættes til en kobber (II) opløsning (f.eks. Cu²⁺ (aq)), et lyseblå bundfald af kobber (II) hydroxid, Cu (OH) ₂ (r), dannes. Dette skyldes reaktionen af kobberioner med hydroxidioner produceret fra ligevægt af ammoniak i vand:
`` `
Cu²⁺ (aq) + 2OH⁻ (aq) ⇌ cu (OH) ₂ (s)
`` `
2. Kompleks dannelse: Efterhånden som der tilsættes mere ammoniak, opløses bundfaldet, og en dybblå opløsning vises. Dette skyldes, at ammoniak fungerer som en ligand, der koordinerer med kobber (II) -ionen for at danne komplekse ioner. Den indledende reaktion er dannelsen af diaminkomplekset:
`` `
Cu²⁺ (aq) + 2nh₃ (aq) ⇌ [cu (nh₃) ₂] ²⁺ (aq)
`` `
3. tetraaminkompleks: Tilføjelse af endnu mere ammoniak skifter ligevægten yderligere, hvilket fører til dannelsen af tetraaminecopper (II) -komplekset:
`` `
[Cu (nh₃) ₂] ²⁺ (aq) + 2nh₃ (aq) ⇌ [cu (nh₃) ₄] ²⁺ (aq)
`` `
Hvorfor overskydende ammoniak er nødvendig:
* opløselighed: Dannelsen af tetraaminkomplekset foretrækkes af den almindelige ioneffekt. Overskydende ammoniak tvinger ligevægten mod dannelsen af tetraaminkomplekset ved at fjerne de frie kobber (II) -ioner fra opløsning, hvilket forhindrer yderligere udfældning af Cu (OH) ₂.
* stabilitet: Tetraaminkomplekset er mere stabilt end diaminkomplekset. Den overskydende ammoniak skubber ligevægten videre til højre og favoriserer dannelsen af tetraaminkomplekset.
* dybblå farve: Den intense dybblå farve er karakteristisk for TetraamineCopper (II) -komplekset. Uden tilstrækkelig ammoniak vil opløsningen forekomme lysere blå eller endda grønlig på grund af tilstedeværelsen af andre komplekse ioner.
Kortfattet: Overskydende ammoniak er nødvendig for at:
* Opløs det indledende kobber (ii) hydroxidudfældning
* Kør ligevægten mod dannelsen af tetraaminkomplekset
* Opnå den karakteristiske dybblå farve på TetraamineCopper (II) -komplekset.
Sidste artikelHvad er forvitring ved krystalvækst?
Næste artikelEr brintgas et organisk stof?
 Varme artikler
Varme artikler
-
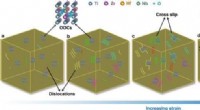 Forbedret styrke og duktilitet i en legering med høj entropi via bestilte iltkomplekserSkematisk diagram, der illustrerer mekanismen for plastisk deformation i den kubiske struktur af den iltrige high-entropy legering (HEA). a) I de ilt-høje entropylegeringer, de bestilte iltkomplekser
Forbedret styrke og duktilitet i en legering med høj entropi via bestilte iltkomplekserSkematisk diagram, der illustrerer mekanismen for plastisk deformation i den kubiske struktur af den iltrige high-entropy legering (HEA). a) I de ilt-høje entropylegeringer, de bestilte iltkomplekser -
 Bygninger i menneskelig knogle kan være nøglen til stærkere 3-D-printede letvægtsstrukturerIngeniører designede et materiale med samme mængde stav- og pladelignende strukturer som menneskelige trabekler og arrangerede dem i et periodisk mønster, præsenterer en ny måde at styrke lette 3D-pri
Bygninger i menneskelig knogle kan være nøglen til stærkere 3-D-printede letvægtsstrukturerIngeniører designede et materiale med samme mængde stav- og pladelignende strukturer som menneskelige trabekler og arrangerede dem i et periodisk mønster, præsenterer en ny måde at styrke lette 3D-pri -
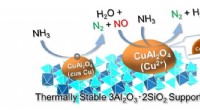 Ny katalysator gør ammoniak til et innovativt rent brændstofCuOx/3A2S producerer selektivt N 2 og H 2 O fra NH 3 gennem en to-trins reaktion. Kredit:Dr. Satoshi Hinokuma At træffe foranstaltninger mod klimaændringer og konvertere til samfund, der bru
Ny katalysator gør ammoniak til et innovativt rent brændstofCuOx/3A2S producerer selektivt N 2 og H 2 O fra NH 3 gennem en to-trins reaktion. Kredit:Dr. Satoshi Hinokuma At træffe foranstaltninger mod klimaændringer og konvertere til samfund, der bru -
 Sød succes:Nyt enzymatisk biosystem høster potentialet i sukkermaltosenKredit:Unsplash/CC0 Public Domain Mikroorganismefri enzymbaserede reaktionssystemer bruges nu til produktion af brint, bioelektricitet og nyttige biokemikalier. I disse biosystemer nedbrydes råmate
Sød succes:Nyt enzymatisk biosystem høster potentialet i sukkermaltosenKredit:Unsplash/CC0 Public Domain Mikroorganismefri enzymbaserede reaktionssystemer bruges nu til produktion af brint, bioelektricitet og nyttige biokemikalier. I disse biosystemer nedbrydes råmate


