Hvorfor er aluminiumsforbindelser sure?
1. Aluminiumioner (al³⁺):
* i vandige løsninger: Aluminiumioner fungerer som Lewis -syrer og accepterer elektronpar. Dette skyldes, at de har en høj positiv ladning og en lille ionisk radius, hvilket gør dem meget polariserende. De kan reagere med vandmolekyler, trække elektroner fra dem og frigive H⁺ioner, hvilket gør opløsningen sur.
* i faste forbindelser: Aluminiumioner i faste forbindelser udviser muligvis ikke nødvendigvis sur opførsel.
2. Aluminiumoxider og hydroxider:
* aluminiumoxid (al₂o₃): Det er amfoterisk, hvilket betyder, at det kan fungere som både en syre og en base. Det reagerer med stærke syrer til dannelse af aluminiumssalte og med stærke baser til dannelse af aluminater.
* aluminium hydroxid (AL (OH) ₃): I lighed med aluminiumoxid er det amfoterisk. I sure opløsninger fungerer det som en base og reagerer på at danne aluminiumioner. I basale opløsninger fungerer det som en syre og reagerer på at danne aluminationer.
3. Aluminiumsalte:
* aluminiumchlorid (alcl₃): I vandig opløsning hydrolyserer den, frigiver H⁺ioner og gør opløsningen sur. Dette sker, fordi ALCL₃ reagerer med vandmolekyler, hvilket producerer aluminiumshydroxid og saltsyre.
* aluminiumssulfat (al₂ (so₄) ₃): I lighed med aluminiumchlorid hydrolyserer det også i opløsning, hvilket resulterer i frigivelse af H⁺ioner og et surt miljø.
Kortfattet:
Mens aluminiumioner i sig selv kan fungere som Lewis -syrer, afhænger den samlede surhed eller basicitet af en aluminiumforbindelse af det specifikke kemiske miljø og interaktionerne mellem forbindelsen med dens omgivelser. Ikke alle aluminiumsforbindelser er sure, og nogle kan endda udvise grundlæggende egenskaber.
Sidste artikelEr brom et metal ikke -metal eller metalloid?
Næste artikelHvad er den kemiske formel for kobber 1 sulfid?
 Varme artikler
Varme artikler
-
 En simpel mekanisme kunne have været afgørende for livets udviklingEt hold ved det tekniske universitet i München (TUM) har for første gang vist, at faseadskillelse er en yderst effektiv måde at styre udvælgelsen af kemiske byggesten på, giver fordele til visse mol
En simpel mekanisme kunne have været afgørende for livets udviklingEt hold ved det tekniske universitet i München (TUM) har for første gang vist, at faseadskillelse er en yderst effektiv måde at styre udvælgelsen af kemiske byggesten på, giver fordele til visse mol -
 En levende engangslaser printet på chip til lægemiddelscreeningKredit:Nanyang Technological University Forskere har skabt en ny måde at overvåge subtile lægemiddelinteraktioner mellem bakterier og antibiotika. Ved at bruge en almindelig kontor inkjet printer,
En levende engangslaser printet på chip til lægemiddelscreeningKredit:Nanyang Technological University Forskere har skabt en ny måde at overvåge subtile lægemiddelinteraktioner mellem bakterier og antibiotika. Ved at bruge en almindelig kontor inkjet printer, -
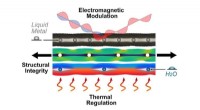 Brug af bioinspireret mikrovaskulatur til at kontrollere materialeegenskaberKredit:North Carolina State University Forskere har skabt og demonstreret et nyt vaskulært metamateriale, der kan omkonfigureres til at ændre dets termiske og elektromagnetiske egenskaber. Vi hen
Brug af bioinspireret mikrovaskulatur til at kontrollere materialeegenskaberKredit:North Carolina State University Forskere har skabt og demonstreret et nyt vaskulært metamateriale, der kan omkonfigureres til at ændre dets termiske og elektromagnetiske egenskaber. Vi hen -
 At tænke uden for buret:En ny tilgang til energiintensive molekylære adskillelserKAUST-forskere udvikler organiske burlignende materialer til at adskille xylenisomerer på en mere energieffektiv måde. Kredit:KAUST; Anastasia Serin En omvendt form for vært-gæstekemi kunne hæmme
At tænke uden for buret:En ny tilgang til energiintensive molekylære adskillelserKAUST-forskere udvikler organiske burlignende materialer til at adskille xylenisomerer på en mere energieffektiv måde. Kredit:KAUST; Anastasia Serin En omvendt form for vært-gæstekemi kunne hæmme
- Hvad er forskellen mellem varmeenergi og temperatur?
- Hvordan er blæserbobler relateret til fysik?
- Hvilken måleenhed ville du bruge til at måle en tegnebog?
- Hvordan dannes granodiorit?
- FCC foreslår bøder for telefonvirksomheder, der delte brugerdata
- Hvad er en klump af energi forbundet med lys kaldet?


