Beskriv, hvordan interaktionen mellem et enzym og dets underlag ændrer en kemisk reaktion?
1. Substratbinding:
* Enzymer har specifikke aktive steder, lommer eller kløfter, der er komplementære i form og opladning til deres specifikke underlag.
* Dette giver mulighed for en midlertidig interaktion, som en lås og nøgle, hvor underlaget binder til det aktive sted og danner et enzym-substratkompleks.
2. Sænkning af aktiveringsenergi:
* Bindingen af underlaget til det aktive sted forårsager en ændring i enzymets form, hvilket bringer substratmolekylerne i en bestemt orientering, der favoriserer reaktionen.
* Denne interaktion svækker bindingerne i underlaget og sænker aktiveringsenergien, som er den minimale energi, der kræves for at reaktionen kan forekomme.
* Ved at sænke aktiveringsenergien tillader enzymet reaktionen at fortsætte meget hurtigere end den ville uden enzymet.
3. Katalyse og produktdannelse:
* Enzymet letter den kemiske transformation af underlaget, bryder eller danner bindinger, hvilket fører til dannelse af produkter.
* Når reaktionen er afsluttet, frigøres produkterne fra det aktive sted, og enzymet er frit til at binde til et andet substratmolekyle.
4. Specificitet:
* Enzymer er meget specifikke, hvilket betyder, at de kun katalyserer en bestemt reaktion eller et lille sæt relaterede reaktioner.
* Denne specificitet opstår fra den nøjagtige pasform mellem enzymets aktive sted og dets specifikke underlag.
Kortfattet:
Samspillet mellem et enzym og dets substrat:
* øger reaktionshastigheden Ved at sænke aktiveringsenergien.
* letter dannelsen af produkter gennem specifikke interaktioner på det aktive sted.
* sikrer høj specificitet På grund af lås og nøglepasning mellem enzym og substrat.
Denne interaktion er grundlæggende for alle biologiske processer, da det muliggør effektive og kontrollerede kemiske transformationer i levende organismer.
Sidste artikelHvad er mulige løsninger på sur regn?
Næste artikelHvor mange ioner er til stede NH4?
 Varme artikler
Varme artikler
-
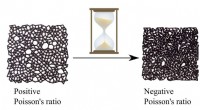 Brug af en materialehukommelse til at kode unikke fysiske egenskaberForskere har vist, at et materiales naturlige ældningsproces kan udnyttes til at skabe materialer med usædvanlige egenskaber. Kredit:Nidhi Pashine En ny undersøgelse offentliggjort i Videnskabens
Brug af en materialehukommelse til at kode unikke fysiske egenskaberForskere har vist, at et materiales naturlige ældningsproces kan udnyttes til at skabe materialer med usædvanlige egenskaber. Kredit:Nidhi Pashine En ny undersøgelse offentliggjort i Videnskabens -
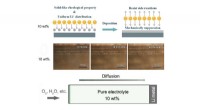 Hydrofob silica kolloid elektrolyt lover sikrere lithium-oxygen batterierSkematisk graf og eksperimentelle data, der viser den lithiumdendritforebyggende effekt af 10 vægt% HSCE. Skematisk graf og eksperimentelle data, der viser antikorrosionseffekten af 10 vægt% HSCE. K
Hydrofob silica kolloid elektrolyt lover sikrere lithium-oxygen batterierSkematisk graf og eksperimentelle data, der viser den lithiumdendritforebyggende effekt af 10 vægt% HSCE. Skematisk graf og eksperimentelle data, der viser antikorrosionseffekten af 10 vægt% HSCE. K -
 Farmakoskopi muliggør opdagelse af immunmodulerende lægemidler ved at analysere immuncelleinterakt…Gregory Vladimer, Nikolaus Krall, Berend Snijder og Giulio Superti-Furga (fra venstre mod højre) er ved siden af Pharmacoscopy high-throughput mikroskop. Kredit:Wolfgang Däuble/CeMM Immunsysteme
Farmakoskopi muliggør opdagelse af immunmodulerende lægemidler ved at analysere immuncelleinterakt…Gregory Vladimer, Nikolaus Krall, Berend Snijder og Giulio Superti-Furga (fra venstre mod højre) er ved siden af Pharmacoscopy high-throughput mikroskop. Kredit:Wolfgang Däuble/CeMM Immunsysteme -
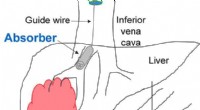 Lægemiddelsvamp kan minimere bivirkninger af kræftbehandlingForeslået tilgang til lægemiddelfangst ved hjælp af en 3D-printet absorber til endovaskulær behandling af leverkræft. Kemoterapimedicinen administreres intra-arterielt via leverarterien (bunden). Over
Lægemiddelsvamp kan minimere bivirkninger af kræftbehandlingForeslået tilgang til lægemiddelfangst ved hjælp af en 3D-printet absorber til endovaskulær behandling af leverkræft. Kemoterapimedicinen administreres intra-arterielt via leverarterien (bunden). Over
- Anklagere race, klasseskævhed kan ikke føre til forskelle i strafferetsplejen
- Forskere udvikler nyt materiale til længerevarende brændselsceller
- Hvor mange i 1 pund naturgas?
- Hvilken Si The Kilby Science Award?
- Elektroder i rumdragter kunne beskytte astronauter mod skadeligt støv på Mars
- Foder crickets af alge- og vandrør?


