Hvorfor er lithiumhydroxid og carbonat den mindst opløselige blandt gruppe1 metalhydroxider carbonater?
Her er hvorfor:
* opløselighedstrend: Generelt øges opløseligheden af gruppe 1 metalhydroxider og carbonater ned i gruppen.
* Lithiums undtagelse: Lithium, der er det mindste og mest elektronegative element i gruppe 1, udviser nogle unikke egenskaber.
* gitterenergi: Lithiumhydroxid og carbonat har højere gitterenergier end den anden gruppe 1 metalhydroxider og carbonater. Dette skyldes, at Lithiums lille størrelse og høje ladningstæthed fører til stærkere elektrostatiske attraktioner inden for krystalgitteret.
* Hydratiseringsenergi: Mens lithiumioner har en høj hydratiseringsenergi, er den ikke høj nok til at overvinde den stærke gitterenergi.
Derfor er lithiumhydroxid og carbonat faktisk mere opløseligt end natriumhydroxid og carbonat, men mindre opløseligt end kalium, rubidium og cæsiumhydroxider og carbonater.
Sammendrag:
* opløselighedstrend: Øges ned i gruppen.
* Lithiums undtagelse: På grund af høj gitterenergi er lithiumhydroxid og carbonat mindre opløselige end deres tungere kolleger.
Det er vigtigt at bemærke, at selvom lithiumhydroxid og carbonat er mindre opløselige end de andre medlemmer af gruppe 1, betragtes de stadig som opløselige i vand.
Sidste artikelEr helium en gas eller metal?
Næste artikelHvad reagerer med molekyler i lavere atmosfære for at producere giftstoffer?
 Varme artikler
Varme artikler
-
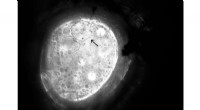 Natures frostvæske giver en formel for mere holdbar betonDette billede viser, hvordan iskrystaller, der binder til polymermolekylerne, oplever dynamisk isformning, skifte fra en kugle til en afrundet sekskant, som forskerne kalder citronis. Kredit:Living Ma
Natures frostvæske giver en formel for mere holdbar betonDette billede viser, hvordan iskrystaller, der binder til polymermolekylerne, oplever dynamisk isformning, skifte fra en kugle til en afrundet sekskant, som forskerne kalder citronis. Kredit:Living Ma -
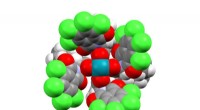 Ny katalysator styrer aktiveringen af en carbon-hydrogenbindingDirhodium (vist med blåt) driver reaktionen, mens formen på stilladset omkring det styrer hvilken CH-binding katalysatoren virker på. Kredit:Kuangbiao Liao, Emory Universitet. Kemikere har udvikle
Ny katalysator styrer aktiveringen af en carbon-hydrogenbindingDirhodium (vist med blåt) driver reaktionen, mens formen på stilladset omkring det styrer hvilken CH-binding katalysatoren virker på. Kredit:Kuangbiao Liao, Emory Universitet. Kemikere har udvikle -
 Aflytning af australske edderkoppers hemmeligheder unikt silkeKurve-spindderkoppen i sin naturlige form med sin unikke hummerpottespind og silke, som nu er blevet afsløret som enestående robust. Kredit:Professor Mark Elgar, University of Melbourne Et interna
Aflytning af australske edderkoppers hemmeligheder unikt silkeKurve-spindderkoppen i sin naturlige form med sin unikke hummerpottespind og silke, som nu er blevet afsløret som enestående robust. Kredit:Professor Mark Elgar, University of Melbourne Et interna -
 Forskere finder en ny metode til at kontrollere elektroniske egenskaber af nanokrystallerFra venstre mod højre:XPD-strålelinjeforsker Sanjit Ghose, postdoktor Anna Plonka, og Brookhaven kemiker Anatoly Frenkel. Kredit:Brookhaven National Laboratory Forskere fra The Hebrew University o
Forskere finder en ny metode til at kontrollere elektroniske egenskaber af nanokrystallerFra venstre mod højre:XPD-strålelinjeforsker Sanjit Ghose, postdoktor Anna Plonka, og Brookhaven kemiker Anatoly Frenkel. Kredit:Brookhaven National Laboratory Forskere fra The Hebrew University o
- Rumfarme vil fodre astronauter og jordboere
- Er forbrænding af en røgelsespind som fysisk eller en kemisk ændring give grund?
- Hvad er 3 typer energioverførsel?
- Hvad sker der, hvis du blander klorargon og natrium sammen?
- Ny forskning viser, at kriser som COVID-19-pandemi truer støtten til afsnit IX
- Hvordan anvendes loven om energibesparelse i kraftværk?


