Hvad er entalpien af ammoniumchlorid?
* entalpi er en tilstandsfunktion: Det afhænger af de specifikke betingelser i systemet, primært temperatur og tryk.
* Forskellige former: Ammoniumchlorid (NH₄CL) kan eksistere i forskellige former (fast, flydende, gas), og hver har en unik entalpi -værdi.
* entalpi ændringer: Vi taler typisk om entalpiændringer (ΔH), der repræsenterer forskellen i entalpi mellem to stater. Disse ændringer er mere nyttige i kemi, som til reaktioner eller faseovergange.
Her er nogle almindelige entalpi -værdier relateret til ammoniumchlorid:
* Standard entalpi af dannelse (ΔHF °) :Dette henviser til entalpiændringen, når en mol af en forbindelse dannes fra dens elementer i deres standardtilstande (25 ° C og 1 atm -tryk). Standard entalpi af dannelse af fast ammoniumchlorid er -314,4 kJ/mol .
* entalpi af opløsning (ΔHSoln) :Dette er enthalpiændringen, når en mol af et stof opløses i et opløsningsmiddel. Entalpien af opløsning for ammoniumchlorid i vand er +14,8 kJ/mol , hvilket betyder, at opløsningsprocessen er endoterm (absorberer varme).
* entalpi af sublimering (ΔHSubl) :Dette er entalpiændringen, når en mol af et fast stof direkte ændrer sig til en gas. For ammoniumchlorid er denne værdi ~ 150 kJ/mol .
For at få en specifik entalpi -værdi for ammoniumchlorid skal du specificere:
1. fasen af ammoniumchlorid (solid, flydende, gas)
2. Temperaturen og trykket
Fortæl mig, hvis du har en bestemt kontekst i tankerne, og jeg kan hjælpe dig med at finde den relevante entalpi -værdi!
Sidste artikelHvad er ligningen for reaktion af kul med ilt?
Næste artikelHvad er det mest rigelige kemiske stof i kroppen?
 Varme artikler
Varme artikler
-
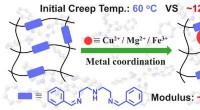 Metalkoordination muliggør høj temperatur, krybe-resistent polyimin vitrimer præparatLet forberedelse af polyimin vitrimere med forbedret krybebestandighed, termiske og mekaniske egenskaber via metalkoordination. Kredit:NIMTE Den biobaserede polymergruppe ved Ningbo Institute of M
Metalkoordination muliggør høj temperatur, krybe-resistent polyimin vitrimer præparatLet forberedelse af polyimin vitrimere med forbedret krybebestandighed, termiske og mekaniske egenskaber via metalkoordination. Kredit:NIMTE Den biobaserede polymergruppe ved Ningbo Institute of M -
 Undersøgelse viser, hvordan små rum kunne have været forud for cellerForskere brugte Argonnes Advanced Photon Source til at studere membranløse rum kaldet komplekse coacervater, da de gennemgik våd-tør-cykler, en undersøgelse, der kaster lys over den prebiotiske jord o
Undersøgelse viser, hvordan små rum kunne have været forud for cellerForskere brugte Argonnes Advanced Photon Source til at studere membranløse rum kaldet komplekse coacervater, da de gennemgik våd-tør-cykler, en undersøgelse, der kaster lys over den prebiotiske jord o -
 Forskere bruger elektrostatisk ladning til at samle partikler til materialer, der efterligner ædels…Til venstre, små krystaller afbildes ved hjælp af et scanningselektronmikroskop, skelne mellem de enkelte byggesten, som består af kugleformede polystyrenperler. Til højre, større krystaller afbildes
Forskere bruger elektrostatisk ladning til at samle partikler til materialer, der efterligner ædels…Til venstre, små krystaller afbildes ved hjælp af et scanningselektronmikroskop, skelne mellem de enkelte byggesten, som består af kugleformede polystyrenperler. Til højre, større krystaller afbildes -
 Ammoniak til brændselscellerTraditionel brændselscelleforskning involverer brintstofbrændselsceller, men UD -forskere konstruerer brændselsceller, der udnytter ammoniak, molekylet afbildet ovenfor, i stedet. Kredit:University of
Ammoniak til brændselscellerTraditionel brændselscelleforskning involverer brintstofbrændselsceller, men UD -forskere konstruerer brændselsceller, der udnytter ammoniak, molekylet afbildet ovenfor, i stedet. Kredit:University of
- Elon Musk siger, at en vellykket jomfruflyvning for Falcon Heavy er usandsynlig (opdatering)
- Bærer meteor stråling, når det kommer til jorden?
- Hvad har O2 H2 CO2 N2 til fælles?
- Hvilket arbejde laver de i pfizer?
- Hvad kaldes en stor faldende bevægelse af løse klipper og jord?
- Hvor mange gram gør en træblyant måde?


