Hvilken masse CCL4 dannes ved reaktionen 8,00 g methan med et overskydende chlorid?
1. Skriv den afbalancerede kemiske ligning:
CH₄ + 4Cl₂ → CCL₄ + 4HCl
2. Beregn den molære masse af metan (CH₄):
* C:12,01 g/mol
* H:1,01 g/mol
* Molmasse Ch₄ =12,01 + (4 * 1,01) =16,05 g/mol
3. Beregn molen af metan:
* Mol =masse / molær masse
* Mol ch₄ =8,00 g / 16,05 g / mol =0,498 mol
4. Brug molforholdet fra den afbalancerede ligning:
* Den afbalancerede ligning viser et forhold på 1:1 mol mellem CH₄ og CCL₄. Dette betyder, at hver 1 mol Ch₄ reagerede, 1 mol CCL₄ produceres.
5. Beregn molen af CCL₄ dannet:
* Mol ccl₄ =0,498 mol
6. Beregn den molære masse af CCL₄:
* C:12,01 g/mol
* Cl:35,45 g/mol
* Molmasse CCL₄ =12,01 + (4 * 35,45) =153,81 g/mol
7. Beregn massen af CCL₄ dannet:
* Masse =mol * molmasse
* Masse CCL₄ =0,498 mol * 153,81 g/mol = 76,7 g
Derfor dannes 76,7 g CCL₄ ved reaktionen.
Sidste artikelEr det at blande epsom salt og ammoniak en kemisk ændring?
Næste artikelEr kloropløselig i varmt eller koldt vand?
 Varme artikler
Varme artikler
-
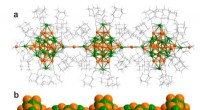 Teknik til fremstilling af funktionelle materialer baseret på polymerer af metalklyngerFigur a:Visualisering af en lineær polymer af 34-atom sølv-guldklyngerne med metal-metalbinding mellem klyngerne i vandret retning (guld:orange, sølv:grøn, ligandmolekyler (ethynyladamantan) er vist m
Teknik til fremstilling af funktionelle materialer baseret på polymerer af metalklyngerFigur a:Visualisering af en lineær polymer af 34-atom sølv-guldklyngerne med metal-metalbinding mellem klyngerne i vandret retning (guld:orange, sølv:grøn, ligandmolekyler (ethynyladamantan) er vist m -
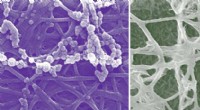 Ny cellulær indsigt i knogleudviklingCalciumphosphatmineralisering forekommer i både ekstra- og intrafibrillære rum af kollagen (venstre og højre billeder, henholdsvis). Ingeniører ved Washington University i St. Louis forsøgte eksperime
Ny cellulær indsigt i knogleudviklingCalciumphosphatmineralisering forekommer i både ekstra- og intrafibrillære rum af kollagen (venstre og højre billeder, henholdsvis). Ingeniører ved Washington University i St. Louis forsøgte eksperime -
 Forskere udvikler værktøj til at hjælpe med udvikling, effektiviteten af brintdrevne bilerSkematisk indre funktion af elektroderne i en brændselscelle, og vigtigheden af nøgleparametre. Kredit:Heinz et al., 2021 Udbredt anvendelse af brintdrevne køretøjer frem for traditionelle elekt
Forskere udvikler værktøj til at hjælpe med udvikling, effektiviteten af brintdrevne bilerSkematisk indre funktion af elektroderne i en brændselscelle, og vigtigheden af nøgleparametre. Kredit:Heinz et al., 2021 Udbredt anvendelse af brintdrevne køretøjer frem for traditionelle elekt -
 COVID-19:Et wake-up call for at genbalancere lægemiddelforsyningskæden?Kredit:CC0 Public Domain Over 80 % af de kemikalier, der bruges til at fremstille lægemidler, der sælges i Europa, stammer fra Kina eller Indien, ifølge European Fine Chemicals Group. Da COVID-19
COVID-19:Et wake-up call for at genbalancere lægemiddelforsyningskæden?Kredit:CC0 Public Domain Over 80 % af de kemikalier, der bruges til at fremstille lægemidler, der sælges i Europa, stammer fra Kina eller Indien, ifølge European Fine Chemicals Group. Da COVID-19
- Diskuter bevægelsen af et legeme kastet fra en bestemt højde?
- Hvordan er en solformørkelse forskellig fra måneoplysning med hensyn til deres forekomst og de inv…
- Hvad er formålet med magneter i elektriske generatorer?
- Hvor varmt kan Venus komme i sin atmosfære?
- Langsigtet undersøgelse viser kilder til sort kulstof i Arktis
- Hvilke dyr spreder frø?


