Tegn den bedste Lewis-struktur for bro4- perbromate ion og bestem formel ladning på brom et af iltatomer?
1. Tæl valenselektroner
* Brom (BR) har 7 valenselektroner.
* Oxygen (O) har 6 valenselektroner.
* Den negative ladning tilføjer en ekstra elektron.
* Samlede valenselektroner:7 + (4 * 6) + 1 =32
2. Bestem det centrale atom
* Brom (BR) er det mindst elektronegative element og vil være det centrale atom.
3. Forbind atomer med enkeltbindinger
* Tilslut de fire iltatomer til bromatomet med enkeltbindinger. Dette bruger 8 valenselektroner (4 bindinger * 2 elektroner pr. Bind).
4. Distribuer resterende elektroner som ensomme par
* Vi har 24 valenselektroner tilbage (32 i alt - 8 brugt).
* Distribuer disse som ensomme par omkring iltatomerne, hvilket giver hvert iltatom tre ensomme par (6 elektroner). Dette bruger alle 24 resterende elektroner.
5. Kontroller for Octet -regelopfyldelse
* Alle iltatomer har en fuld octet (2 elektroner fra den enkelte binding + 6 fra ensomme par).
* Brom har også en fuld oktet (8 elektroner fra de fire bindinger).
6. Formel gebyrberegning
* formel ladning =(valenselektroner) - (ikke -bindende elektroner) - (1/2 bindingselektroner)
* formel opladning på brom (BR):
* Valenselektroner =7
* Ikke-bindende elektroner =0
* Bindingselektroner =8
* Formel opladning =7 - 0 - (8/2) =+1
* formel ladning på et af iltatomerne (O):
* Valenselektroner =6
* Ikke-bindende elektroner =6
* Limning elektroner =2
* Formel opladning =6 - 6 - (2/2) =-1
Lewis -struktur:
`` `
O
|
O - Br - O
|
O
`` `
Formelle gebyrer:
* brom (Br):+1
* ilt (O):-1
Vigtig note: De formelle afgifter er et værktøj til at hjælpe os med at forstå fordelingen af elektroner. Perbromationen er en resonanshybrid, hvilket betyder, at den faktiske struktur er et gennemsnit af flere mulige strukturer. Den negative ladning delokaliseres på tværs af alle fire iltatomer.
 Varme artikler
Varme artikler
-
 Selvhelbredende guldpartiklerGuldatomer er flyttet ind i bulen produceret før, fylder det næsten helt op. Kredit:KIT Selvhelbredende materialer er i stand til selvstændigt at reparere defekter, såsom ridser, revner eller bule
Selvhelbredende guldpartiklerGuldatomer er flyttet ind i bulen produceret før, fylder det næsten helt op. Kredit:KIT Selvhelbredende materialer er i stand til selvstændigt at reparere defekter, såsom ridser, revner eller bule -
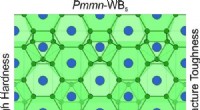 Forskere forudser et nyt superhårdt materiale med unikke egenskaberKredit:The Journal of Physical Chemistry Letters Et internationalt hold af forskere har rapporteret om et nyt superhårdt materiale, der kunne bruges til boring, maskinbygning og andre områder. D
Forskere forudser et nyt superhårdt materiale med unikke egenskaberKredit:The Journal of Physical Chemistry Letters Et internationalt hold af forskere har rapporteret om et nyt superhårdt materiale, der kunne bruges til boring, maskinbygning og andre områder. D -
 Atomisk opfattelse af naturens fantastiske molekylære maskiner på arbejdeMetoden hit and return (HARE) forenkler optagelse af snapshot-film af biomolekyler på arbejdet. Kredit:J. M. Harms, MPSD Forskere fra MPSDs Institut for Atomically Resolved Dynamics ved Center for
Atomisk opfattelse af naturens fantastiske molekylære maskiner på arbejdeMetoden hit and return (HARE) forenkler optagelse af snapshot-film af biomolekyler på arbejdet. Kredit:J. M. Harms, MPSD Forskere fra MPSDs Institut for Atomically Resolved Dynamics ved Center for -
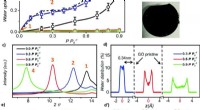 Opsuger vandet og sveden - et nyt super tørremiddelVandadsorption af grafenoxid. (a) Adsorptionsisotermer af GO, silicagel, grafit og rGO ved 25 °C. (b) Fotografi af GO-laminater (toptørret ved 80 °C og bundmættet ved P P0−1 =0,6). (c) XRD-mønstre af
Opsuger vandet og sveden - et nyt super tørremiddelVandadsorption af grafenoxid. (a) Adsorptionsisotermer af GO, silicagel, grafit og rGO ved 25 °C. (b) Fotografi af GO-laminater (toptørret ved 80 °C og bundmættet ved P P0−1 =0,6). (c) XRD-mønstre af
- Har astronomer opdaget nogen jordstørrelse planeter omkring normale stjerner endnu?
- Hvordan man opbygger dit eget vindgeneratorsystem
- I hvilket miljø kan du forvente en kemisk sedimentær bjergart?
- Hvor mange Troy ounces i et pund?
- Hvordan påvirker havbundens spredning os?
- Hvordan kommer energi i et elektrisk afsætningsmarked til dig?


