Hvad er mekanismen for ferrisk chlorid -test?
1. Dannelse af en fenolation:
- Ferrichlorid (FECL3) reagerer med den fenoliske forbindelse i opløsning, som typisk er i dens neutrale form.
- Ferriskionen (Fe3+) fungerer som en Lewis -syre og accepterer et elektronpar fra det fenoliske iltatom.
- Dette danner en fenolation, som er en negativt ladet art.
2. Kompleks dannelse:
- Fenolationen koordinerer derefter med ferriskionen og danner et farvet kompleks.
- Farven på komplekset afhænger af den specifikke struktur af phenolen og reaktionsbetingelserne.
3. Farveændringer:
- for fenoler: Komplekset vises typisk som en grøn, blå eller lilla farve.
- for Enols: Farven kan være anderledes, såsom rød, gul eller orange.
- Andre forbindelser: Nogle andre forbindelser, som salicylsyre, kan også give en positiv ferrisk chlorid -test.
mekanisme:
Reaktionen kan repræsenteres af følgende ligning:
`` `
AROH + FECL3 → [ARO-FECL2] + HCL
`` `
hvor:
* Aroh repræsenterer den fenoliske forbindelse
* FECL3 repræsenterer ferricchlorid
* [ARO-FECL2] repræsenterer det farvede kompleks
Faktorer, der påvirker testen:
Flere faktorer kan påvirke resultatet af ferrisk chlorid -test, herunder:
* ph: Reaktionen kræver et surt miljø, så testen udføres typisk i en let sur opløsning.
* Koncentration: Koncentrationen af den fenoliske forbindelse og ferrichloridopløsningen kan påvirke farveintensiteten og reaktionstiden.
* Temperatur: Reaktionen er generelt mere gunstig ved højere temperaturer.
* Andre reagenser: Tilstedeværelsen af andre reagenser, såsom oxidationsmidler, kan forstyrre testen.
Begrænsninger:
* falske positive: Nogle forbindelser, som salicylsyre, kan give et falskt positivt resultat.
* falske negativer: Ikke alle fenoler vil give et positivt resultat. Nogle fenoler, især dem med voluminøse substituenter, reagerer muligvis ikke med jernchlorid.
Generelt er ferricchlorid -testen en enkel og hurtig metode til påvisning af tilstedeværelsen af fenoler og enols. Det er dog vigtigt at være opmærksom på dets begrænsninger og bekræfte resultater med andre analytiske teknikker.
 Varme artikler
Varme artikler
-
 En kemisk omfavnelse fra den perfekte værtGengwu Zhang udfører adskillelseseksperimentet ved hjælp af to ekstraktionstårne. Kredit:© 2020 KAUST En industriel proces, der i øjeblikket bruger store mængder energi i petrokemiske anlæg rundt
En kemisk omfavnelse fra den perfekte værtGengwu Zhang udfører adskillelseseksperimentet ved hjælp af to ekstraktionstårne. Kredit:© 2020 KAUST En industriel proces, der i øjeblikket bruger store mængder energi i petrokemiske anlæg rundt -
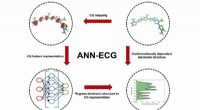 Ny tilgang til molekylær modellering kan fremskynde udviklingen af nye organiske materialer til e…Skematisk af ANN-EKG-metoden anvendt i dette arbejde. Skematisk eksempel viser en tre-perle/monomer grovkornet molekylær modelkortlægning for sexi (3-methyl) thiophen. Kredit:Argonne National Laborato
Ny tilgang til molekylær modellering kan fremskynde udviklingen af nye organiske materialer til e…Skematisk af ANN-EKG-metoden anvendt i dette arbejde. Skematisk eksempel viser en tre-perle/monomer grovkornet molekylær modelkortlægning for sexi (3-methyl) thiophen. Kredit:Argonne National Laborato -
 Neutrontomografi:Indsigt i det indre af tænder, rodkugler, batterier, og brændselscellerFossiler som dette 250 millioner år gamle kranium af en lystrosaurus kan undersøges meget omhyggeligt ved neutrontomografi. Kredit:MfN Berlin Et team af forskere ved Helmholtz-Zentrum Berlin (HZB)
Neutrontomografi:Indsigt i det indre af tænder, rodkugler, batterier, og brændselscellerFossiler som dette 250 millioner år gamle kranium af en lystrosaurus kan undersøges meget omhyggeligt ved neutrontomografi. Kredit:MfN Berlin Et team af forskere ved Helmholtz-Zentrum Berlin (HZB) -
 Forskere opnår termokemiluminescens i fast tilstand med krystallerFaststof termokemiluminescens af krystaller, der udsender lys, når de opvarmes, optaget af NYUAD-forskere. Kredit:Dr. Stefan Schramm Fundene, offentliggjort i tidsskriftet Naturkommunikation , d
Forskere opnår termokemiluminescens i fast tilstand med krystallerFaststof termokemiluminescens af krystaller, der udsender lys, når de opvarmes, optaget af NYUAD-forskere. Kredit:Dr. Stefan Schramm Fundene, offentliggjort i tidsskriftet Naturkommunikation , d
- Nyt promiskuøst enzym hjælper med at gøre planteaffald til bæredygtige produkter
- Database relancering for at hjælpe med at beskytte truet maritim arkæologi
- Variabelt solskin – forskere forklarer, hvorfor vores sols lysstyrke svinger
- Forklar, hvordan stof kan klassificeres i blandinger af rene stofferforbindelser og elementer?
- Grønt og sødt:Hvordan plantesukker påvirker malariatransmission
- Har en planet mindre tyngdekraft, hvis den er længere væk fra solen?


