Hvad sker der gik rent barium tilsættes til en opløsning af sølvacetat?
Her er den afbalancerede kemiske ligning:
BA (S) + 2AGC2H3O2 (aq) → Ba (C2H3O2) 2 (aq) + 2ag (s)
Her er en sammenbrud af, hvad der sker:
* barium (BA) er et meget reaktivt metal, mere reaktivt end sølv.
* sølvacetat (AGC2H3O2) er en opløselig ionisk forbindelse, hvilket betyder, at den adskiller sig i dens ioner (Ag+ og C2H3O2-) i opløsning.
* Når barium tilsættes, fortrænger det sølvioner fra opløsningen og danner bariumacetat.
* Dette skyldes, at barium har en højere tendens til at miste elektroner og danne positive ioner (BA2+) sammenlignet med sølv.
* Reaktionen resulterer i dannelsen af fast sølvmetal, der udfælder ud af opløsningen.
Observationer:
* Du vil observere dannelsen af en gråhvid bundfald (sølvmetal) i opløsningen.
* Opløsningen kan blive lidt overskyet på grund af tilstedeværelsen af bariumacetat, som også er opløselig, men kan have et let mælkeagtigt udseende.
* Der kan være en vis boblende eller brus, som reaktionen fortsætter på grund af frigivelsen af små mængder brintgas.
Vigtig note: Denne reaktion er meget eksoterm og kan være kraftig. Det er vigtigt at udføre denne reaktion med forsigtighed og passende sikkerhedsforanstaltninger på plads.
Sidste artikelHvor mange mol ammoniak kan fremstilles, hvis 7,5 brint reagerer med nok nitrogen?
Næste artikelHvilken type stof er råolie?
 Varme artikler
Varme artikler
-
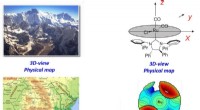 Kortlægning af den tredimensionelle struktur af katalytiske centre hjælper med at designe nye og f…3D -strukturen af landskabsbilledet (øverst til venstre) kan sammenlignes med 3D -billedet af katalysatoren (øverst til højre). Tilsvarende det geografiske kort (nederst til venstre) kan sammenligne
Kortlægning af den tredimensionelle struktur af katalytiske centre hjælper med at designe nye og f…3D -strukturen af landskabsbilledet (øverst til venstre) kan sammenlignes med 3D -billedet af katalysatoren (øverst til højre). Tilsvarende det geografiske kort (nederst til venstre) kan sammenligne -
 Forskere afslører en hemmelighed bag stærkere metallerFor første gang har forskere beskrevet, hvordan de små krystallinske korn, der udgør de fleste faste metaller, faktisk dannes. At forstå denne proces, siger de, kunne teoretisk set føre til måder at p
Forskere afslører en hemmelighed bag stærkere metallerFor første gang har forskere beskrevet, hvordan de små krystallinske korn, der udgør de fleste faste metaller, faktisk dannes. At forstå denne proces, siger de, kunne teoretisk set føre til måder at p -
 Se, hvordan en kovalent polymer udvikler sig ved hjælp af et scanningstunnelmikroskopUorden-til-orden overgang. Kredit:Nature (2022). DOI:10.1038/s41586-022-04409-6 Et team af forskere fra KU Leuven, University of Aveiro, OLYMAT, University of the Basque Country UPV/EHU og Ikerbasq
Se, hvordan en kovalent polymer udvikler sig ved hjælp af et scanningstunnelmikroskopUorden-til-orden overgang. Kredit:Nature (2022). DOI:10.1038/s41586-022-04409-6 Et team af forskere fra KU Leuven, University of Aveiro, OLYMAT, University of the Basque Country UPV/EHU og Ikerbasq -
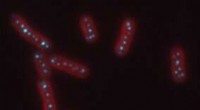 Forståelse af membranen i membranløse organellerPå billedet ses et fluorescensbillede af cyanobakterier, i rødt, med carboxysomer, i cyan. Kredit:Biteen og Vecchiarelli Labs Organeller i celler er små motorer, der indkapsler processer, der till
Forståelse af membranen i membranløse organellerPå billedet ses et fluorescensbillede af cyanobakterier, i rødt, med carboxysomer, i cyan. Kredit:Biteen og Vecchiarelli Labs Organeller i celler er små motorer, der indkapsler processer, der till
- NASAs GPM analyserede nedbør i den tidligere Tropical Cyclone 11S
- Undersøgelse:Uddannelse og urbanisering øger afrikanske kvinders kontrol over sundhed syd for Saha…
- Google har en plan om at nedstirre falske nyheder om ukrainske flygtninge i Europa
- I hvilken vinkel rammer strålerne mest direkte Jorden?
- Hvad sker der med den kinetiske energi fra en maskine, når den stopper?
- Hvad sker der, når et natriumatom mister en elektron i sin ydre energi -skal?


