Hvorfor er vand en væske ved stuetemperatur med molt volumen på 18 ml og 105 grader C 1 ATM -tryk Det gas 30L?
Her er en sammenbrud:
* Hydrogenbinding: Vandmolekyler har en speciel type binding kaldet en brintbinding. Denne binding dannes mellem de lidt positive hydrogenatomer i et vandmolekyle og det lidt negative iltatom i et andet vandmolekyle. Disse bindinger er stærke nok til at holde vandmolekyler sammen i en flydende tilstand ved stuetemperatur.
* Polaritet: Vand er et polært molekyle, hvilket betyder, at det har en positiv ende (brint) og en negativ ende (ilt). Denne polaritet forbedrer hydrogenbinding yderligere og skaber et stærkt netværk af attraktioner mellem vandmolekyler.
* densitet: Vand er overraskende tæt for et lille molekyle. Denne densitet tilskrives hydrogenbindingen, der pakker molekylerne tæt sammen.
* faseovergange: Når du opvarmer vand, øger du den kinetiske energi fra dens molekyler. Ved stuetemperatur er den kinetiske energi nok til at holde vandmolekylerne i bevægelse og interagerende, men ikke nok til at bryde brintbindingerne fuldstændigt. Når du opvarmer vand til 100 ° C (212 ° F), overvinder den kinetiske energi hydrogenbindingen, og vandmolekylerne overgår til en gasfase (damp).
* Volumenudvidelse: Den dramatiske stigning i volumen fra 18 ml til 30L, når vand skifter fra væske til gas skyldes den meget større bevægelsesfrihed og adskillelse mellem gasmolekyler. I gasfasen er de attraktive kræfter mellem molekylerne meget svagere, og de spreder sig markant.
Kortfattet: Vandets flydende tilstand ved stuetemperatur er et resultat af stærk hydrogenbinding mellem dens polære molekyler. Denne binding opretholder en høj densitet og stærke intermolekylære attraktioner. Opvarmningsvand giver nok energi til at overvinde disse bindinger, hvilket forårsager faseovergangen til en gas, hvor molekyler er langt mere spredt.
Sidste artikelHvilket element er i gruppe 2 og har færre protoner end kalium?
Næste artikelHvor mange elementer er der i et atom af svovl?
 Varme artikler
Varme artikler
-
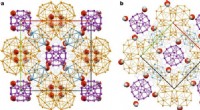 To Frank-Kasper faser i saltkrystalstrukturer observereten, Fase 1. b, Fase 2. Klynger A1, A2, B og C er farvet i lilla, orange, blå og grå, henholdsvis. I begge strukturer, lidelse er blevet fjernet for klarhedens skyld. Chlorider er blevet forbundet for
To Frank-Kasper faser i saltkrystalstrukturer observereten, Fase 1. b, Fase 2. Klynger A1, A2, B og C er farvet i lilla, orange, blå og grå, henholdsvis. I begge strukturer, lidelse er blevet fjernet for klarhedens skyld. Chlorider er blevet forbundet for -
 Oprydning af beskidte keramiske fliser produktionProduktion af keramiske fliser. Kredit:Ceramiche Atlas Concorde Spa Produktion af keramiske fliser. Kredit:Ceramiche Atlas Concorde Spa Energieffektiviteten i ovne og andre processtadier af kerami
Oprydning af beskidte keramiske fliser produktionProduktion af keramiske fliser. Kredit:Ceramiche Atlas Concorde Spa Produktion af keramiske fliser. Kredit:Ceramiche Atlas Concorde Spa Energieffektiviteten i ovne og andre processtadier af kerami -
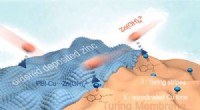 Turing-membran for at forbedre ydeevnen af zinkbaserede batterierDendritfrit zinkbaseret batteri med høj arealkapacitet udviklet via den regioninducerede aflejringseffekt af Turing-membran. Kredit:Wu Jine Zinkbaserede batterier er lovende muligheder for energil
Turing-membran for at forbedre ydeevnen af zinkbaserede batterierDendritfrit zinkbaseret batteri med høj arealkapacitet udviklet via den regioninducerede aflejringseffekt af Turing-membran. Kredit:Wu Jine Zinkbaserede batterier er lovende muligheder for energil -
 Forskere opdager et nyt uorganisk materiale med den laveste varmeledningsevne, der nogensinde er rap…Brug den rigtige kemi, det er muligt at kombinere to forskellige atomarrangementer (gule og blå plader), der giver mekanismer til at bremse varmebevægelsen gennem et fast stof. Denne strategi giver de
Forskere opdager et nyt uorganisk materiale med den laveste varmeledningsevne, der nogensinde er rap…Brug den rigtige kemi, det er muligt at kombinere to forskellige atomarrangementer (gule og blå plader), der giver mekanismer til at bremse varmebevægelsen gennem et fast stof. Denne strategi giver de
- Kan Kunming-Montreals globale biodiversitetsramme opfylde sit transformative potentiale?
- Hvilken art er Lirpa -loof relateret til?
- Ædle plastik vil have dig til at bygge dit eget plastgenbrugscenter
- Er der noget ud over det ydre rum?
- Hvilken slags energi absorberer atmosfæren fra jorden, efter at Jorden absorberer infrarøde strål…
- COVID-pensum bringer naturvidenskab hjem til gymnasieelever


