Er KBR i H2O en ion-dipol-attraktion?
* KBR er en ionisk forbindelse: KBR består af kaliumioner (K⁺) og bromidioner (BR⁻) holdt sammen af elektrostatiske kræfter.
* vand er et polært molekyle: Vand har en bøjet form, hvor iltatomet er mere elektronegativt end hydrogenatomerne. Dette resulterer i en delvis negativ ladning på ilt og delvis positive ladninger på hydrogenerne, hvilket gør vand til et polært molekyle.
* ion-dipol-interaktion: Når KBR opløses i vand, tiltrækkes de positivt ladede kaliumioner (K⁺) af de delvist negative iltatomer af vandmolekyler. Tilsvarende tiltrækkes de negativt ladede bromidioner (BR⁻) af de delvist positive hydrogenatomer af vandmolekyler. Disse elektrostatiske attraktioner mellem ionerne og de polære vandmolekyler kaldes ion-dipol-interaktioner.
Kortfattet: Opløsningen af KBR i vand drives af de gunstige ion-dipol-interaktioner, der overvinder gitterenergien i KBR-krystallen.
Sidste artikelHvad er der lavet af kulstof og brint?
Næste artikelAntallet af iltatomer i 6Ch3Cooh?
 Varme artikler
Varme artikler
-
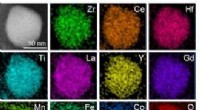 En schweizisk hærkniv-katalysator kan gøre naturgasforbrændingen renereDe grundstoffer, der udgør metaloxid-nanopartikelkatalysatoren. Kredit:Zhennan Huang Reza Shahbazian-Yassar, professor i maskin- og industriteknik ved University of Illinois, Chicago. Shahbazian-
En schweizisk hærkniv-katalysator kan gøre naturgasforbrændingen renereDe grundstoffer, der udgør metaloxid-nanopartikelkatalysatoren. Kredit:Zhennan Huang Reza Shahbazian-Yassar, professor i maskin- og industriteknik ved University of Illinois, Chicago. Shahbazian- -
 Ny teknik til at skabe super-svampe er en game changerForskere har udtænkt nye metoder til postsyntetisk modifikation af metal-organiske rammer for at producere egenskaber i materialet, der er ideelt til gasmanipulation. Kredit:DGIST Metal-organiske
Ny teknik til at skabe super-svampe er en game changerForskere har udtænkt nye metoder til postsyntetisk modifikation af metal-organiske rammer for at producere egenskaber i materialet, der er ideelt til gasmanipulation. Kredit:DGIST Metal-organiske -
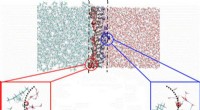 Toppe af vandige bølger kan transportere vitale kemikalier i industriel separationsprocesHvordan molekyler bevæger sig og organiserer sig i vand, når væsken møder olien, afhænger af, om kemikaliet er på toppen eller truget af en lille bølge af vand ved grænsefladen. Kredit:US Department o
Toppe af vandige bølger kan transportere vitale kemikalier i industriel separationsprocesHvordan molekyler bevæger sig og organiserer sig i vand, når væsken møder olien, afhænger af, om kemikaliet er på toppen eller truget af en lille bølge af vand ved grænsefladen. Kredit:US Department o -
 Nyt bormateriale med høj hårdhed skabt af plasmakemisk dampaflejringYogesh Vohra. Kredit:UAB Yogesh Vohra, Ph.D., bruger mikrobølge-plasma kemisk dampaflejring til at skabe tynde krystalfilm af aldrig før sete materialer. Denne indsats søger materialer, der nærmer
Nyt bormateriale med høj hårdhed skabt af plasmakemisk dampaflejringYogesh Vohra. Kredit:UAB Yogesh Vohra, Ph.D., bruger mikrobølge-plasma kemisk dampaflejring til at skabe tynde krystalfilm af aldrig før sete materialer. Denne indsats søger materialer, der nærmer
- Er egenskaberne ved klor det samme som natriumchlorid?
- I rumkapsler, lidt plads men stor forbedring
- Sådan udføres en brandpumpekurvtest
- Hvordan vi forvandlede en golfbane til et fristed for sjældne salamandere, frøer og tudser
- Hvad er de 3 energiloven?
- Undergruppe af kulstofnanorør udgør en kræftrisiko svarende til asbest hos mus


