Hvor mange mol nitrogenoxid NO kan produceres fra nedbrydningen 4 N2O2CL2?
1. Afbalanceret kemisk ligning:
Først har vi brug for den afbalancerede kemiske ligning til nedbrydning af n₂o₂cl₂:
2 n₂o₂cl₂ → 4 no + 2 cl₂ + o₂
2. Molforhold:
Den afbalancerede ligning fortæller os, at 2 mol N₂O₂cl₂ producerer 4 mol nr.
3. Beregning:
Da du har 4 mol n₂o₂cl₂, kan vi oprette en andel for at finde molen uden produceret:
(2 mol n₂o₂cl₂) / (4 mol nr) =(4 mol n₂o₂cl₂) / (x mol nr)
Løsning for X:
x =(4 mol n₂o₂cl₂ * 4 mol nr) / (2 mol n₂o₂cl₂)
x =8 mol nr.
Svar: 8 mol nitrogenoxid (NO) kan produceres fra nedbrydningen af 4 mol N₂O₂CL₂.
Sidste artikelHvorfor er kemisk forvitring et problem?
Næste artikelHvor mange molekyler har H2O?
 Varme artikler
Varme artikler
-
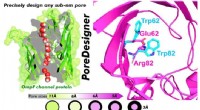 PoreDesigner forbedrer proteinkanaldesign til vandbehandling, bioseparationerFigur, der skitserer det grundlæggende i PoreDesigners arbejdsgang til ændring af porestørrelsen af et bakteriekanalprotein. Kredit:Manish Kumar / Penn State PoreDesigner, en fuldt automatiseret
PoreDesigner forbedrer proteinkanaldesign til vandbehandling, bioseparationerFigur, der skitserer det grundlæggende i PoreDesigners arbejdsgang til ændring af porestørrelsen af et bakteriekanalprotein. Kredit:Manish Kumar / Penn State PoreDesigner, en fuldt automatiseret -
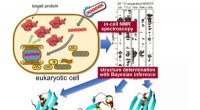 In-situ måling af 3-D proteinstruktur inde i levende eukaryote cellerMålproteiner udtrykkes indeni sf9 celler, derefter målt under anvendelse af in-cell NMR-spektroskopi. Unik statistisk analyse ved hjælp af Bayesiansk slutning anvendes til at beregne den nøjagtige
In-situ måling af 3-D proteinstruktur inde i levende eukaryote cellerMålproteiner udtrykkes indeni sf9 celler, derefter målt under anvendelse af in-cell NMR-spektroskopi. Unik statistisk analyse ved hjælp af Bayesiansk slutning anvendes til at beregne den nøjagtige -
 En magnetisk kork til fjernelse af vandforureningKredit:Carlos III Universitetet i Madrid Universidad Carlos III de Madrid (UC3M), sammen med Universidad Pontificia de Comillas og universitetet i Porto, har patenteret en magnetisk korkprop, der
En magnetisk kork til fjernelse af vandforureningKredit:Carlos III Universitetet i Madrid Universidad Carlos III de Madrid (UC3M), sammen med Universidad Pontificia de Comillas og universitetet i Porto, har patenteret en magnetisk korkprop, der -
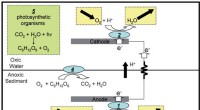 NRL udstedt patent for solar mikrobiel brændselscelleSkematisk skildring af forenklet mekanisme til energiproduktion af den bentiske mikrobielle brændselscelle (BMFC), uden boks mærket 5 svarende til fotosyntese, og for den mikrobielle fotoelektrokemisk
NRL udstedt patent for solar mikrobiel brændselscelleSkematisk skildring af forenklet mekanisme til energiproduktion af den bentiske mikrobielle brændselscelle (BMFC), uden boks mærket 5 svarende til fotosyntese, og for den mikrobielle fotoelektrokemisk
- Nedfaldne efterårsblade er en værdifuld ressource. Sådan får du mest ud af dem
- Hvilke landformer danner oceanic-oceaniske grænser?
- Hvad er den videnskabelige definition af Epic Center?
- Enkeltatom-tynd platin er en fantastisk kemisk sensor
- Smeltningspunktet for H2O er 0 grader celsius dette det samme som hvad?
- Hvad kan påvirke kemiske resultater?


