Hvordan sammenlignes egenskaberne ved salt med natrium og klor?
natrium (NA):
* tilstand: Blød, sølvhvid fast stof ved stuetemperatur
* reaktivitet: Meget reaktivt metal. Reagerer voldsomt med vand, producerer brintgas og meget varme.
* toksicitet: Giftig i sin elementære form kan forårsage forbrændinger og alvorlige sundhedsmæssige problemer.
* anvendelser: Brugt i mange industrielle processer, herunder produktion af natriumhydroxid og andre kemikalier.
klor (CL):
* tilstand: Gulgrøn gas ved stuetemperatur
* reaktivitet: Meget reaktiv ikke -metal. Et kraftfuldt oxidationsmiddel.
* toksicitet: Meget giftig gas kan forårsage luftvejsproblemer og død.
* anvendelser: Brugt i vandbehandling, blegning og produktion af mange kemikalier.
salt (NaCl):
* tilstand: Hvidt krystallinsk fast stof ved stuetemperatur
* reaktivitet: Relativt ureaktive, ikke-giftige i moderate mængder.
* toksicitet: Høje niveauer af saltindtagelse kan føre til sundhedsmæssige problemer som højt blodtryk.
* anvendelser: Væsentligt for menneskets og dyreliv, der bruges som aroma -agent, konserveringsmiddel og i mange industrielle processer.
Nøgleforskelle:
* Kemisk binding: Natrium og klor er begge elementer med forskellige egenskaber. Når de reagerer, danner de en ionisk binding, hvor natrium mister et elektron for at blive en positivt ladet ion (Na+), og klor får et elektron til at blive en negativt ladet ion (Cl-). Denne overførsel af elektroner ændrer fuldstændigt egenskaberne for den resulterende forbindelse, salt.
* Fysisk tilstand: Natrium og klor er begge i forskellige fysiske tilstande ved henholdsvis stuetemperatur (fast og gas), mens salt er et fast stof.
* reaktivitet: Natrium og klor er stærkt reaktive elementer, mens salt er relativt ureaktiv. Dette skyldes den stabile ioniske binding dannet mellem natrium og klor.
* toksicitet: Natrium og klor er begge giftige i deres elementære form, mens salt er vigtigt for livet i moderate mængder.
I resuméet er salt et helt andet stof end natrium og klor. Det er en stabil forbindelse dannet gennem en kemisk reaktion, der ændrer egenskaberne for de individuelle elementer.
 Varme artikler
Varme artikler
-
 Forskere afslører strukturen af aminosyretransportør involveret i kræftForskere fra University of Groningen involveret i undersøgelsen - venstre til højre, stående:D.J. Slotboom, A. Guskov, A.A. Garaeva, C. Paulino - siddende:G.T. Oostergetel. Kredit:University of Gronin
Forskere afslører strukturen af aminosyretransportør involveret i kræftForskere fra University of Groningen involveret i undersøgelsen - venstre til højre, stående:D.J. Slotboom, A. Guskov, A.A. Garaeva, C. Paulino - siddende:G.T. Oostergetel. Kredit:University of Gronin -
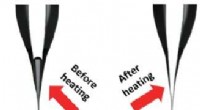 Komplet fyldning af partier af nanopipetterAnbringelse af et parti nanopipetter på en varmeplade inducerer en termisk gradient, som muliggør fuldstændig fyldning af pipetterne med en opløsning. Kredit:Kanazawa University Forskere ved Kanaz
Komplet fyldning af partier af nanopipetterAnbringelse af et parti nanopipetter på en varmeplade inducerer en termisk gradient, som muliggør fuldstændig fyldning af pipetterne med en opløsning. Kredit:Kanazawa University Forskere ved Kanaz -
 Eliminerer revner i 3-D-printede metalkomponenterKredit:istock Forskere ved EPFL har udviklet en ny laser 3-D-printteknik til fremstilling af metalkomponenter med hidtil uset modstandsdygtighed over for høje temperaturer, skader og korrosion. Me
Eliminerer revner i 3-D-printede metalkomponenterKredit:istock Forskere ved EPFL har udviklet en ny laser 3-D-printteknik til fremstilling af metalkomponenter med hidtil uset modstandsdygtighed over for høje temperaturer, skader og korrosion. Me -
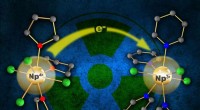 Åbner adgang til at udforske neptuniums syntetiske kemiEn ny, let fremstillet udgangsmateriale (til venstre) indeholdende neptunium (Np3+) kan let fremstilles ved en elektron (e-) overførsel til en moder neptunium (Np4+) forbindelse (højre). Denne proces
Åbner adgang til at udforske neptuniums syntetiske kemiEn ny, let fremstillet udgangsmateriale (til venstre) indeholdende neptunium (Np3+) kan let fremstilles ved en elektron (e-) overførsel til en moder neptunium (Np4+) forbindelse (højre). Denne proces
- Får zink let i brand?
- Temperatur er et mål for gennemsnittet Hvilken energi en objekter partikler?
- Dobbeltstjernesystem vender planetdannende skive til polposition
- United forsinker igen returneringen af Boeings 737 MAX
- Beskriv hver form for indre farvande?
- Underjordiske forbindelser mellem jordskælv og udbrud af Japans største aktive vulkan


