Hvorfor er ilt en gas?
Her er hvorfor:
* Oxygenmolekyler (O2) er små og ikke -polære. De har en symmetrisk struktur, hvilket betyder, at elektronerne er fordelt jævnt. Dette resulterer i svage London -spredningskræfter (LDF'er) som den eneste intermolekylære kraft mellem dem. LDF'er er midlertidige attraktioner, der opstår fra svingende elektronskyer.
* LDF'erne mellem iltmolekyler er meget svage. Dette skyldes, at molekylerne er små, og elektronerne holdes tæt.
* svage intermolekylære kræfter betyder, at iltmolekylerne let kan overvinde tiltrækningen til hinanden og bevæge sig frit. Dette er grunden til, at ilt findes som en gas ved stuetemperatur.
Lad os kontrastere dette med andre stoffer:
* vand (H2O) er en væske ved stuetemperatur. Det har stærkere brintbindinger mellem molekyler, som er mere signifikante end LDF'erne i ilt.
* natriumchlorid (NaCl) er et fast stof ved stuetemperatur. Det danner et krystalgitter med stærke ioniske bindinger og holder molekylerne tæt sammen.
Sammenfattende er Oxygen's gasformige tilstand ved stuetemperatur et resultat af dens lille størrelse, ikke -polære karakter og de svage London -spredningskræfter mellem dens molekyler.
Sidste artikelHvad er der i dimethyl benzyl ammonium saccharinat?
Næste artikelHvad hedder de vigtigste kemiske atomer?
 Varme artikler
Varme artikler
-
 Papir uden mikroplast:En økonomisk og miljøvenlig belægningEn papirkop belagt med det nye MSU-materiale til venstre holder væske uden at lække, i modsætning til dens ubelagte modstykke til højre. Kredit:Muhammad Rabnawaz/Sustainable Materials Group Michig
Papir uden mikroplast:En økonomisk og miljøvenlig belægningEn papirkop belagt med det nye MSU-materiale til venstre holder væske uden at lække, i modsætning til dens ubelagte modstykke til højre. Kredit:Muhammad Rabnawaz/Sustainable Materials Group Michig -
 Forskere foreslår en ny teknologi til at skabe magnetmikrostrukturerKonfigurationen af en tynd krystalfilm. Kredit:Anton Tarasov Et team af videnskabsmænd fra Krasnoyarsk Scientific Center (Siberian Department of Russian Academy of Sciences) og Siberian Federal
Forskere foreslår en ny teknologi til at skabe magnetmikrostrukturerKonfigurationen af en tynd krystalfilm. Kredit:Anton Tarasov Et team af videnskabsmænd fra Krasnoyarsk Scientific Center (Siberian Department of Russian Academy of Sciences) og Siberian Federal -
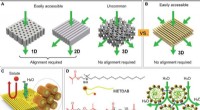 Selvsamlet membran med vandkontinuerlige transportveje til præcis nanofiltreringSkematisk illustration af selvsamlede strukturer, der bruges til at fremstille nanoporøse polymermembraner. (A) De to let opnåelige morfologier, dvs. lameller og cylindre, kræve tilpasning af struktur
Selvsamlet membran med vandkontinuerlige transportveje til præcis nanofiltreringSkematisk illustration af selvsamlede strukturer, der bruges til at fremstille nanoporøse polymermembraner. (A) De to let opnåelige morfologier, dvs. lameller og cylindre, kræve tilpasning af struktur -
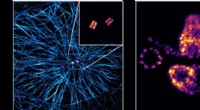 Fremskridt inden for superopløselig mikroskopiTil venstre, en udvidet menneskelig celle med mikrotubuli (blå) og et par centrioler (gul-rød) i midten. Til højre den detaljerede struktur af to udvidede par centrioler. Kredit:Fabian Zwettler / Univ
Fremskridt inden for superopløselig mikroskopiTil venstre, en udvidet menneskelig celle med mikrotubuli (blå) og et par centrioler (gul-rød) i midten. Til højre den detaljerede struktur af to udvidede par centrioler. Kredit:Fabian Zwettler / Univ
- Hvor produceres radium?
- Hvilken type naturfenonenom forklares i Ceres Proserpina?
- Hvad er den empiriske formel for en forbindelse, der opdeles i 4,12 g N og 0,88 g H?
- Fremskridt inden for distribueret fiberoptisk vibration/akustisk sensorteknologi
- Vindmysteriet inde i gasgiganten Saturn begynder at optrevle
- Hvad er ligheder og forskelle mellem fysisk kemisk forvitring?


