Hvordan fremstiller du mættet kaliumniteret -løsning?
Forståelse af mætning
En mættet opløsning er en, hvor ikke mere opløst stof (i dette tilfælde KNO3) kan opløses i opløsningsmidlet (vand) ved en given temperatur.
Materialer:
* Kaliumnitrat (KNO3)
* Destilleret vand
* Bægerglas
* Omrøring af stang
* Varmekilde (f.eks. Hotplade eller Bunsen -brænder)
* Termometer
Procedure:
1. Varm vandet: Opvarm det destillerede vand til ca. 60-70 ° C (140-160 ° F). Dette giver mulighed for større opløselighed af KNO3.
2. Tilføj kaliumnitrat: Tilsæt gradvist KNO3 til det opvarmede vand, mens du omrører kontinuerligt.
3. Rør kontinuerligt: Fortsæt med at omrøre for at sikre, at KNO3 opløses så meget som muligt.
4. Kontroller for mætning: Når du tilføjer KNO3, vil du bemærke, at løsningen bliver mere koncentreret. Til sidst når du et punkt, hvor KNO3 stopper opløsningen, og enhver yderligere KNO3 vil slå sig ned i bunden af bægerglas. Dette er mætningens punkt.
5. Tillad at køle: Lad den mættede opløsning forsigtigt afkøle til stuetemperatur. Når det afkøles, kan nogle af KnO3 krystallisere ud af opløsningen.
6. filter (valgfrit): Hvis du vil have en klar, mættet opløsning, skal du filtrere opløsningen gennem filterpapir for at fjerne eventuelle uopløsede KnO3 -krystaller.
Vigtige overvejelser:
* Temperatur: Opløseligheden af KNO3 øges markant med temperaturen. En mættet opløsning ved en højere temperatur vil indeholde mere KNO3 end en ved en lavere temperatur.
* renhed: Brug destilleret vand til at minimere urenheder, der kan påvirke opløseligheden af KNO3.
* sikkerhed: Bær sikkerhedsbriller og handsker, når du håndterer KNO3.
* Krystallisation: Når opløsningen afkøles, kan KNO3 -krystaller dannes. Dette er normalt. Du kan ofte opløse disse krystaller ved forsigtigt at genopvarme opløsningen.
Lad mig vide, om du gerne vil vide mere om specifikke anvendelser af mættede kaliumnitratopløsninger.
Sidste artikelKlor smelter ved 172 K Hvad er klor smeltepunkt?
Næste artikelHvilke elementer udgør kaliumbromid?
 Varme artikler
Varme artikler
-
 Udvikling af nye måder at fremme kobberproduktion påEn prøve af næsten rent kobber aflejres på en jernelektrode efter ekstraktion gennem en elektrokemisk proces udviklet af forskere i laboratoriet hos MIT-lektor Antoine Allanore. Kredit:Denis Paiste/Ma
Udvikling af nye måder at fremme kobberproduktion påEn prøve af næsten rent kobber aflejres på en jernelektrode efter ekstraktion gennem en elektrokemisk proces udviklet af forskere i laboratoriet hos MIT-lektor Antoine Allanore. Kredit:Denis Paiste/Ma -
 Forskere laver en fotografisk film af en molekylær switchMolekylær struktur af den fotoresponsive molekylære switch (i midten) omgivet af opløsningsmiddelmolekyler. Forskerne afslørede en lys-induceret pedalo-type bevægelse, som går både frem og tilbage. Bi
Forskere laver en fotografisk film af en molekylær switchMolekylær struktur af den fotoresponsive molekylære switch (i midten) omgivet af opløsningsmiddelmolekyler. Forskerne afslørede en lys-induceret pedalo-type bevægelse, som går både frem og tilbage. Bi -
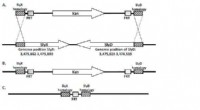 Nye teknologier til fremstilling af medicinske terapeutiske proteiner(A) KanR-kassetten flankeret af SlyX- og SlyD-homologe regioner. (B) Hele sekvensen af disse gener erstattes af KanR-kassetten under rekombination. (C) FRT ar er alt, hvad der er tilbage, når stamme
Nye teknologier til fremstilling af medicinske terapeutiske proteiner(A) KanR-kassetten flankeret af SlyX- og SlyD-homologe regioner. (B) Hele sekvensen af disse gener erstattes af KanR-kassetten under rekombination. (C) FRT ar er alt, hvad der er tilbage, når stamme -
 Forskere omdanner CO til CO2 med et enkelt metalatomTufts University-forsker Charles Sykes har for første gang demonstreret, at et enkelt metalatom kan fungere som en katalysator ved omdannelse af kulilte til kuldioxid. en kemisk reaktion, der almindel
Forskere omdanner CO til CO2 med et enkelt metalatomTufts University-forsker Charles Sykes har for første gang demonstreret, at et enkelt metalatom kan fungere som en katalysator ved omdannelse af kulilte til kuldioxid. en kemisk reaktion, der almindel
- Hvordan membran fungerer i RO?
- Navn og beskriver kort de vigtigste solregioner?
- Polyethylenglycol Vs. Ethylene Glycol
- Vampyrfinker:hvordan små fugle på Galápagos fik smag for store fugleblod
- Har jernsulfat svovl i det?
- Hvad er den afbalancerede reaktion, når en strimmel af magnesium tilsættes til opløsning af sølv…


