Hydrogen og chlor kombineres for at producere saltsyre som vist i ligningen nedenfor H2 C12 - 2HC1 Er denne reaktion eksoterm eller endotermisk?
* eksotermiske reaktioner frigiver varme i omgivelserne. Dette betyder, at produkterne (HCI) er lavere end reaktanternes energi (H₂ og Cl₂).
* obligationsdannelse frigiver energi. Den stærke binding dannet i HCL frigiver mere energi end den energi, der kræves for at bryde bindingerne i H₂ og Cl₂.
Kortfattet: Dannelsen af HCL frigiver mere energi end det tager at bryde startobligationerne, hvilket gør den overordnede proces eksoterm.
Sidste artikelEr brom gas tættere eller mindre tæt end luft?
Næste artikelNaCl H2O- Fysisk eller kemisk ændring?
 Varme artikler
Varme artikler
-
 Video:Den eneste detox, du nogensinde får brug forKredit:The American Chemical Society Folk taler hele tiden om, hvordan de skal afgifte. Og der er en række virksomheder, der er en kilometer lang og venter på at sælge juicer og smoothies til dig
Video:Den eneste detox, du nogensinde får brug forKredit:The American Chemical Society Folk taler hele tiden om, hvordan de skal afgifte. Og der er en række virksomheder, der er en kilometer lang og venter på at sælge juicer og smoothies til dig -
 Detektion af opløsningsmiddeldampe med blotte øjneKredit:University of Tsukuba Sensorer er vigtige til at detektere forurenende stoffer og overvåge miljøforhold. Fluorescerende sensorer kan afsløre tilstedeværelsen af en kontaminant i henhold t
Detektion af opløsningsmiddeldampe med blotte øjneKredit:University of Tsukuba Sensorer er vigtige til at detektere forurenende stoffer og overvåge miljøforhold. Fluorescerende sensorer kan afsløre tilstedeværelsen af en kontaminant i henhold t -
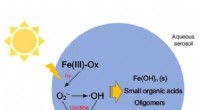 Virkninger af Fenton-lignende reaktioner af ferroloxalat på atmosfæriske oxidationsprocesser og st…Methacrolein reagerer med superoxidradikaler frembragt ved en Fenton-lignende reaktion. Dette påvirker atmosfærisk strålingsforcerende kraft på grund af dannelsen af uopløseligt jernhydroxid. Kredit
Virkninger af Fenton-lignende reaktioner af ferroloxalat på atmosfæriske oxidationsprocesser og st…Methacrolein reagerer med superoxidradikaler frembragt ved en Fenton-lignende reaktion. Dette påvirker atmosfærisk strålingsforcerende kraft på grund af dannelsen af uopløseligt jernhydroxid. Kredit -
 Lille, men selvpålagt:Titanium ændrer værtsgitteratoms adfærdTitan, gitterets herre. Kredit:Daria Sokol, MIPT Forskere fra MIPT og deres kolleger fra Ural Federal University har kombineret optiske og akustiske tilgange og fundet ud af, at inkorporering af t
Lille, men selvpålagt:Titanium ændrer værtsgitteratoms adfærdTitan, gitterets herre. Kredit:Daria Sokol, MIPT Forskere fra MIPT og deres kolleger fra Ural Federal University har kombineret optiske og akustiske tilgange og fundet ud af, at inkorporering af t
- Hvilket lag med sol, der har udbrud, forekommer, når sløjferne i solspotregioner pludselig forbind…
- Hvordan øger du termisk effektivitet til konvertering af varmeenergi til mekanisk EG -forbrændings…
- Hvilken binding dannes med nitrogen og klor?
- Hvad alle følgende er måder, hvorpå sedimentære klipper dannes undtagen A. lavakøling B. Fysisk…
- Er jern, der ruster i fugtig, en fysisk egenskabskemisk ændring eller ændring?
- Er der jord på Nordpolen, eller er det i vand?


