Hvorfor opløses natriumchlorid ikke i ikke-polære opløsningsmidler?
* Polaritetsmæssig mismatch: Natriumchlorid er en ionisk forbindelse, hvilket betyder, at det består af positivt ladede natriumioner (Na+) og negativt ladede chloridioner (CL-). Disse ioner er stærkt tiltrukket af hinanden gennem elektrostatiske kræfter og danner en krystalgitterstruktur. Ikke-polære opløsningsmidler mangler på den anden side nogen signifikant ladningsadskillelse og har svage intermolekylære kræfter. Denne polaritetsmismatch forhindrer, at de ikke-polære opløsningsmiddelmolekyler effektivt overvinder de stærke ioniske bindinger i NaCI.
* "som opløser som": Den generelle regel inden for kemi er, at "som opløses som." Dette betyder, at polære stoffer opløses i polære opløsningsmidler, og ikke-polære stoffer opløses i ikke-polære opløsningsmidler. Da NaCl er meget polær, vil den kun opløses i polære opløsningsmidler.
* Hydrering: I vand (et polært opløsningsmiddel) omgiver vandmolekylerne Na+ og Cl- ioner, der danner hydratiseringsskaller. Disse hydratiseringsskaller hjælper med at svække de ioniske bindinger og giver ionerne mulighed for at adskille og opløses. Ikke-polære opløsningsmidler mangler evnen til at danne sådanne hydratiseringsskaller, hvilket gør det umuligt for ionerne at bryde fri fra krystalgitteret.
* Energikrav: For at NaCl skal opløses i et ikke-polært opløsningsmiddel, ville opløsningsmiddelmolekylerne være nødt til at tilvejebringe nok energi til at overvinde de stærke ioniske bindinger i krystalgitteret. Ikke-polære opløsningsmidler har ikke tilstrækkelig energi til at bryde disse bindinger effektivt.
Sammenfattende forhindrer manglen på polaritet i ikke-polære opløsningsmidler, de stærke ioniske bindinger i NaCI og fraværet af hydratiseringsskaller NaCI i at opløse i disse opløsningsmidler.
Sidste artikelKlorgas og ilt, som er tungt?
Næste artikelHvad er massen på 0,89 mol cacl2?
 Varme artikler
Varme artikler
-
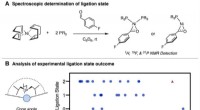 Forudsigelse af fosfinreaktivitet med en simpel metrik%Vbur (min) deskriptoren er unikt i stand til at forudsige spektroskopisk ligeringstilstandsudfald, afslører reaktivitetsklipper i organometallisk kemi. Kredit:Doyle Lab Fosfiner er blandt de vigt
Forudsigelse af fosfinreaktivitet med en simpel metrik%Vbur (min) deskriptoren er unikt i stand til at forudsige spektroskopisk ligeringstilstandsudfald, afslører reaktivitetsklipper i organometallisk kemi. Kredit:Doyle Lab Fosfiner er blandt de vigt -
 En måde at bevidst ændre krumningen af bøjede molekyler ved hjælp af en polymer og ultraviolet…Scanning elektronmikroskopi billede af de kolloidale bananer. Bemærk den falske farve understreger partiklernes form. Skalaen er 5 mikrometer. Kredit:Carla Fernandez-Rico Et team af forskere fra U
En måde at bevidst ændre krumningen af bøjede molekyler ved hjælp af en polymer og ultraviolet…Scanning elektronmikroskopi billede af de kolloidale bananer. Bemærk den falske farve understreger partiklernes form. Skalaen er 5 mikrometer. Kredit:Carla Fernandez-Rico Et team af forskere fra U -
 Undersøgelse viser potentiale for jordvenlig plasterstatningDen nye blanding af bioplast og gummi, der blev udtænkt af forskere i Ohio State, viste sig at være meget mere holdbar end bioplasten på egen hånd Credit:Ohio State University Stræben efter at hol
Undersøgelse viser potentiale for jordvenlig plasterstatningDen nye blanding af bioplast og gummi, der blev udtænkt af forskere i Ohio State, viste sig at være meget mere holdbar end bioplasten på egen hånd Credit:Ohio State University Stræben efter at hol -
 Forskere opdager fælles plan for proteinantibiotikaKredit:CC0 Public Domain En opdagelse af forskere ved Los Angeles Biomedical Research Institute (LA BioMed) har afsløret en fælles plan for proteiner, der har antimikrobielle egenskaber. Denne opd
Forskere opdager fælles plan for proteinantibiotikaKredit:CC0 Public Domain En opdagelse af forskere ved Los Angeles Biomedical Research Institute (LA BioMed) har afsløret en fælles plan for proteiner, der har antimikrobielle egenskaber. Denne opd
- En ny tilgang til 3D-holografiske skærme forbedrer billedkvaliteten i høj grad
- Er der en måling mindre end Volt?
- Hvad skal en bakteriecelle have for at overføre dele af sin kromosom en anden celle?
- Hvordan alger kunne ændre din verden (eller i det mindste bil)
- En ny rejse ind i Jorden for at udforske rummet
- Røntgenteknik giver et nyt vindue til eksotiske egenskaber af et atomtyndt materiale


