Hvilke af disse følger ikke octetreglen NF3 CO2 OF2 BR2 NO?
* octet regel: Octet -reglen siger, at atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration med otte elektroner i deres yderste skal (Valence Shell).
* nf3 (nitrogen trifluorid): Nitrogen har 5 valenselektroner og danner tre enkeltbindinger med fluor, hvilket giver det i alt 8 elektroner (6 fra bindingerne + 2 ensomme par). Det følger oktetreglen.
* CO2 (kuldioxid): Carbon har 4 valenselektroner og danner dobbeltbindinger med to iltatomer. Dette giver carbon 8 -elektroner og hvert ilt 8 elektroner (2 ensomme par + 6 fra bindingerne), der tilfredsstiller oktetreglen.
* af2 (iltdifluorid): Oxygen har 6 valenselektroner og danner to enkeltbindinger med fluor. Dette giver ilt 8 elektroner (2 ensomme par + 6 fra bindingerne) og fluor 8 elektroner hver efter oktetreglen.
* br2 (brom): Brom er et diatomisk molekyle med hvert bromatom, der deler det ene elektron med det andet, hvilket resulterer i, at hver brom har 8 elektroner (4 ensomme par + 4 fra bindingen). Dette følger Octet -reglen.
* nej (nitrogenoxid): Nitrogen har 5 valenselektroner, og ilt har 6. De danner en dobbeltbinding, hvilket giver nitrogen 7 elektroner (2 ensomme par + 5 fra bindingerne) og ilt 8 elektroner. Nitrogen har kun 7 elektroner, hvilket gør det til en undtagelse fra Octet -reglen.
Kortfattet: Nej (nitrogenoxid) er molekylet, der ikke følger oktetreglen.
 Varme artikler
Varme artikler
-
 Små molekyler kan være nøglen til at øge effektiviteten af organiske solcellerTolags solcelle baseret på den organiske halvleder kobber(I) thiocyanat (CuSCN) giver en ny platform for exciton diffusionsundersøgelser. Kredit:KAUST At forstå, hvordan partikler bevæger sig genn
Små molekyler kan være nøglen til at øge effektiviteten af organiske solcellerTolags solcelle baseret på den organiske halvleder kobber(I) thiocyanat (CuSCN) giver en ny platform for exciton diffusionsundersøgelser. Kredit:KAUST At forstå, hvordan partikler bevæger sig genn -
 Video:Hvad er livet? Og vil vi finde det på andre planeter?Kredit:The American Chemical Society Kemi hjælper os med at finde ud af, hvordan livet kom i gang på Jorden og giver os molekyler at kigge efter på andre planeter. I denne episode af reaktioner, v
Video:Hvad er livet? Og vil vi finde det på andre planeter?Kredit:The American Chemical Society Kemi hjælper os med at finde ud af, hvordan livet kom i gang på Jorden og giver os molekyler at kigge efter på andre planeter. I denne episode af reaktioner, v -
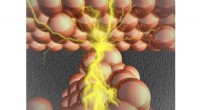 Bygge bro mellem nanoskalaen:Et dybt kig inde i atomkontakterBroen, der dannes i metalsulfidlaget, forbinder to metalelektroder, resulterer i, at atomkontakten tændes. Kredit:Manabu Kiguchi Et team af forskere fra Tokyo Institute of Technology har opnået hi
Bygge bro mellem nanoskalaen:Et dybt kig inde i atomkontakterBroen, der dannes i metalsulfidlaget, forbinder to metalelektroder, resulterer i, at atomkontakten tændes. Kredit:Manabu Kiguchi Et team af forskere fra Tokyo Institute of Technology har opnået hi -
 Strygning af technetiumforureningJerngranulat (til venstre) efter en måneds kontakt med technetium. Set under et scanningselektronmikroskop, de røde pletter (øverst til højre) indikerer, at technetium nu bevares af jernets nyligt dan
Strygning af technetiumforureningJerngranulat (til venstre) efter en måneds kontakt med technetium. Set under et scanningselektronmikroskop, de røde pletter (øverst til højre) indikerer, at technetium nu bevares af jernets nyligt dan
- Hvordan blev bison næsten udslettet?
- Hvad er den kraft, der udøves af en gas, der kaldes?
- Hvilke egenskaber afhænger tyngdekraften mellem to objekter?
- Hvordan dannes underjordiske kalkstenhuler?
- Laboratorieforsøg viser, hvorfor mellemstore myrer ikke kan kravle ud af myrelions larvehuller
- Det meste kriminalitet er faldet med 90 % på 30 år – så hvorfor tror offentligheden, at den er st…


