Hvad sker der, når elektricitet føres gennem vandig opløsning af natriumchlorid?
1. Dissociation:
* I opløsningen opløses og adskiller NaCl sig i sine ioner:
* Na+ (natriumioner)
* cl- (chloridioner)
2. Elektrodeopsætning:
* Elektrolyse kræver to elektroder:en anode (positiv elektrode) og A katode (negativ elektrode).
3. Ionbevægelse:
* kationer (Na+) Gå mod katode (negativ elektrode).
* anioner (cl-) Gå mod anode (positiv elektrode).
4. Reaktioner ved elektroderne:
* ved katoden: Natriumioner (Na+) får elektroner og reduceres til natriummetal:
* Na + + e- → Na
* ved anoden: Chloridioner (Cl-) mister elektroner og oxideres til klorgas:
* 2Cl- → Cl2 + 2e-
5. Samlet reaktion:
* Den samlede reaktion er:
* 2NACl + 2H2O → 2NAOH + H2 + CL2
Resultat:
* natriumhydroxid (NaOH) dannes i opløsningen.
* brintgas (H2) produceres ved katoden.
* klorgas (CL2) produceres ved anoden.
Vigtige noter:
* Reaktionen kræver en jævnstrøm (DC) kilde til elektricitet.
* Elektrolysen af natriumchlorid er en vigtig industriel proces til produktion af klor, natriumhydroxid og brintgas.
Yderligere detaljer:
* Elektrolyseprocessen er påvirket af koncentrationen af NaCl -opløsningen, den påførte spænding og elektrodematerialet.
* Ud over de vigtigste produkter kan der også forekomme nogle bivirkninger, der producerer små mængder af andre stoffer.
* Elektrolysen af vandig NaCI er et centralt eksempel på en redoxreaktion, hvor elektroner overføres fra en art til en anden.
Sidste artikelHvad er den rigtige formel for svovl hexafluorid?
Næste artikelHvad betyder det, at den atomiske munber af kulstof er 6?
 Varme artikler
Varme artikler
-
 Video:Hvad er oktan egentlig?Kredit:The American Chemical Society Når de fleste af os går på tankstationen, vælger vi almindelig eller premium gas uden at tænke for meget over det. Men i denne video vil vi udforske videnskabe
Video:Hvad er oktan egentlig?Kredit:The American Chemical Society Når de fleste af os går på tankstationen, vælger vi almindelig eller premium gas uden at tænke for meget over det. Men i denne video vil vi udforske videnskabe -
 Stort skridt i at producere kulstofneutralt brændstof:sølvdiphosphidKredit:CC0 Public Domain En ny kemisk proces beskrevet i tidsskriftet Naturkommunikation gør i laboratoriet, hvad træer gør i naturen - det omdanner kuldioxid til brugbare kemikalier eller brænd
Stort skridt i at producere kulstofneutralt brændstof:sølvdiphosphidKredit:CC0 Public Domain En ny kemisk proces beskrevet i tidsskriftet Naturkommunikation gør i laboratoriet, hvad træer gør i naturen - det omdanner kuldioxid til brugbare kemikalier eller brænd -
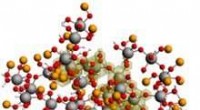 Sporingsmekanismer for krystallisering i realtidAlkaliske opløsninger af aluminium og natriumioner danner komplekse geler (se eksempel) sammensat af aluminiummetalcenternetværk. Under krystallisation, disse netværk frigiver ioner, hvis struktur påv
Sporingsmekanismer for krystallisering i realtidAlkaliske opløsninger af aluminium og natriumioner danner komplekse geler (se eksempel) sammensat af aluminiummetalcenternetværk. Under krystallisation, disse netværk frigiver ioner, hvis struktur påv -
 Eksoskeletal mikrostruktur af ekstremt hårde kokosnøddekrabbekløerSkematisk diagram, der viser tværsnitsstrukturerne af kokoskrabbekloens eksoskelet. Kredit:National Institute for Materials Science NIMS Research Center for Structural Materials og Okinawa Churash
Eksoskeletal mikrostruktur af ekstremt hårde kokosnøddekrabbekløerSkematisk diagram, der viser tværsnitsstrukturerne af kokoskrabbekloens eksoskelet. Kredit:National Institute for Materials Science NIMS Research Center for Structural Materials og Okinawa Churash
- Når kraft forbliver den samme, og massedobler?
- Hvilke ligninger repræsenterer loven om universel gravitation?
- Har du fødevareallergi? Test dit måltid på stedet ved hjælp af en mobiltelefon
- Hvad er sagen fra Nebula, der er begyndt at kondensere under vægt af tyngdekraften Begynd formation…
- Kan du se din egen galakse på nattehimlen?
- Hvilke em -bølger udsendes af ild?


