Hvor mange natriumioner er til stede i 325 ml 0,850 M Na2SO4?
1. Beregn molen af Na₂so₄:
* molaritet (m) =mol opløst / liter opløsning
* Vi har 0,850 m Na₂so₄ og 325 ml (som er 0,325 L).
* Omarranger formlen for at løse for mol:mol =molaritet * liter
* mol na₂so₄ =0,850 m * 0,325 l =0,27625 mol
2. Bestem molen af natriumioner (NA⁺):
* Hver formelenhed i Na₂so₄ indeholder 2 natriumioner (Na⁺).
* mol Na⁺ =2 * mol Na₂so₄ =2 * 0,27625 mol =0,5525 mol
3. Beregn antallet af natriumioner:
* Brug Avogadros nummer (6.022 x 10²³ ioner/mol) til at konvertere mol til ioner.
* Antal Na⁺ioner =0,5525 mol * (6,022 x 10²³ ioner/mol) = 3,32 x 10²³ Na⁺ ioner
Derfor er der ca. 3,32 x 10²³ natriumioner til stede i 325 ml 0,850 m Na₂so₄ -opløsning.
Sidste artikelHvad er ionerne i natriumchloridopløsning?
Næste artikelHvor mange ioner til stede i NaCl -løsning?
 Varme artikler
Varme artikler
-
 Alkymister af cellemiljøetKredit:CiQUS For at analysere, forstå, blande, og korrekt. At forske i livsmaskineri går gennem at dechifrere, hvordan celler, de mindre levende enheder i en organisme, arbejde. At være sund afhæn
Alkymister af cellemiljøetKredit:CiQUS For at analysere, forstå, blande, og korrekt. At forske i livsmaskineri går gennem at dechifrere, hvordan celler, de mindre levende enheder i en organisme, arbejde. At være sund afhæn -
 Effektiv syntese af ginkgo -forbindelse kan føre til nye lægemidler, grønne insekticiderKredit:Scripps Kemikere ved Scripps Research har opfundet en effektiv metode til fremstilling af en syntetisk version af planteforbindelsen bilobalid, som naturligt produceres af gingkotræer. Det
Effektiv syntese af ginkgo -forbindelse kan føre til nye lægemidler, grønne insekticiderKredit:Scripps Kemikere ved Scripps Research har opfundet en effektiv metode til fremstilling af en syntetisk version af planteforbindelsen bilobalid, som naturligt produceres af gingkotræer. Det -
 Naturinspirerede materialer kan bruges i applikationer lige fra tunneling til rumOptisk billede af materialeoverflade efter erosionstest med hastighed på 30 m/s og anslagsvinkel på 30 grader. Kredit:Rahul Kumar Optimale materialer til skærende værktøjer til tunnelboremaskiner
Naturinspirerede materialer kan bruges i applikationer lige fra tunneling til rumOptisk billede af materialeoverflade efter erosionstest med hastighed på 30 m/s og anslagsvinkel på 30 grader. Kredit:Rahul Kumar Optimale materialer til skærende værktøjer til tunnelboremaskiner -
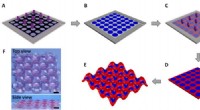 Periodisk mønstrede hydrogeler:en model for kooperativ deformationFotolitografisk mønster af gel og hævelse-induceret kooperativ deformation. (A) en forløberopløsning i reaktionscellen blev udsat for ultraviolet (UV) lysbestråling gennem en maske for at producere mø
Periodisk mønstrede hydrogeler:en model for kooperativ deformationFotolitografisk mønster af gel og hævelse-induceret kooperativ deformation. (A) en forløberopløsning i reaktionscellen blev udsat for ultraviolet (UV) lysbestråling gennem en maske for at producere mø


