Hvordan er partikler i is og kogende vand forskellige?
is (solid tilstand)
* Arrangement: Vandmolekyler er tæt pakket i en regelmæssig, krystallinsk struktur. Denne struktur holdes sammen af stærke brintbindinger mellem molekylerne.
* Bevægelse: Molekyler vibrerer på plads, men har ikke nok energi til at bryde fri fra deres faste positioner. Dette giver is sin stive struktur.
* afstand: Molekyler er meget tæt sammen.
kogende vand (flydende tilstand)
* Arrangement: Vandmolekyler er stadig tæt på hinanden, men de er ikke længere i en fast, krystallinsk struktur. De er frie til at bevæge sig forbi hinanden.
* Bevægelse: Molekyler bevæger sig hurtigere end i is. De har nok energi til at bryde nogle af brintbindingerne, så de kan glide forbi hinanden.
* afstand: Molekyler er lidt længere fra hinanden end i is.
kogende vand vs. is
* Energi: Den største forskel er energi . Vandmolekyler i kogende vand har betydeligt mere kinetisk energi end dem i is. Denne ekstra energi bryder de fleste af brintbindingerne, hvilket gør det muligt for molekylerne at bevæge sig mere frit.
* Temperatur: Temperaturen på kogende vand er meget højere end isens temperatur. Dette afspejler forskellen i energiniveauet for molekylerne.
* densitet: Is er mindre tæt end flydende vand. Dette skyldes, at den krystallinske struktur i is skaber mere plads mellem molekylerne sammenlignet med det mere tilfældigt pakket flydende vand.
Key Takeaway: Materialet (fast, flydende, gas) afhænger af energiniveauet for molekylerne. Når molekylerne får energi, bevæger de sig mere frit og bryder bortset fra deres faste positioner.
Sidste artikelHvad kan du gøre ved sur regn?
Næste artikelHvad er valensen af silikation?
 Varme artikler
Varme artikler
-
 Forskere finder en ny anvendelse af affaldUBCO Postdoc-stipendiat Dr. Chinchu Cherian, sammen med lektor Dr. Sumi Siddiqua, undersøger et vejbygningsmateriale lavet delvist med genanvendt træaske. Kredit:UBCO Affaldsmaterialer fra papirma
Forskere finder en ny anvendelse af affaldUBCO Postdoc-stipendiat Dr. Chinchu Cherian, sammen med lektor Dr. Sumi Siddiqua, undersøger et vejbygningsmateriale lavet delvist med genanvendt træaske. Kredit:UBCO Affaldsmaterialer fra papirma -
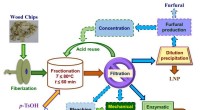 Delignificering af træprøver ved hjælp af p-toluensulfonsyre som en genanvendelig hydrotropSkematisk flowdiagram viser træfraktionering ved hjælp af p-TsOH til produktion af fibre, lignocellulosiske nanomaterialer, sukker, og LNPer. Processer med stiplede linjer blev ikke udført i denne und
Delignificering af træprøver ved hjælp af p-toluensulfonsyre som en genanvendelig hydrotropSkematisk flowdiagram viser træfraktionering ved hjælp af p-TsOH til produktion af fibre, lignocellulosiske nanomaterialer, sukker, og LNPer. Processer med stiplede linjer blev ikke udført i denne und -
 En ny måde at producere rent brintbrændstof fra vand ved hjælp af sollysTransmittanselektronmikroskopisk billede af den sammensatte fotokatalysator med to komponenter, sort phosphor (BP) og grafitisk carbonnitrid (g-C3N4). Kredit:Osaka University Osaka University-lede
En ny måde at producere rent brintbrændstof fra vand ved hjælp af sollysTransmittanselektronmikroskopisk billede af den sammensatte fotokatalysator med to komponenter, sort phosphor (BP) og grafitisk carbonnitrid (g-C3N4). Kredit:Osaka University Osaka University-lede -
 Ingeniører kan opdage ultra sjældne proteiner i blodet ved hjælp af et mobiltelefonkameraForskernes detektionssystem bruger et standard mobiltelefonkamera til at optage video af mikrodråber, når de passerer linsen. Fluorescerende markører kan identificeres individuelt ved at matche dem me
Ingeniører kan opdage ultra sjældne proteiner i blodet ved hjælp af et mobiltelefonkameraForskernes detektionssystem bruger et standard mobiltelefonkamera til at optage video af mikrodråber, når de passerer linsen. Fluorescerende markører kan identificeres individuelt ved at matche dem me
- Hvordan beregner du, om en stjerne er synlig for given breddegrad eller ej?
- Den termiske energi fra mange kilder omdannes til hvilken slags energi?
- Eksempler på gasstatssag?
- Seks måder, robotter bruges på i dag, som du sandsynligvis ikke vidste om
- Forskere viser forskellige mønstre af regnskovens biodiversitet
- Forskere opdager, hvordan fjer får deres glans, inspirerer ideer til at skabe glans


