Kombineres klor med andre elementer?
* Elektronegativitet: Klor har en høj elektronegativitet, hvilket betyder, at det stærkt tiltrækker elektroner. Dette gør det ivrig efter at få et elektron for at opnå en stabil elektronkonfiguration.
* reaktiv ikke -metal: Chlor er et ikke -metal beliggende i gruppe 17 (halogener) af den periodiske tabel. Halogener er kendt for deres reaktivitet.
Eksempler på klorforbindelser:
* natriumchlorid (NaCl): Almindelig tabel salt dannet ved reaktion af klor med natrium.
* hydrogenchlorid (HCL): En farveløs gas, der opløses i vand til dannelse af saltsyre.
* Calciumchlorid (CACL2): Bruges som de-icer og i støvkontrol.
* klordioxid (CLO2): Brugt som desinfektionsmiddel og blegningsmiddel.
* chloroform (CHCL3): Et opløsningsmiddel og bedøvelsesmiddel.
* polyvinylchlorid (PVC): En holdbar plast, der bruges i rør, gulve og andre applikationer.
reaktioner med metaller:
Klor reagerer kraftigt med mange metaller til dannelse af metalchlorider. For eksempel:
* natrium + klor → natriumchlorid
* jern + klor → jernchlorid
reaktioner med ikke -metaller:
Klor kan også reagere med andre ikke -metaller, såsom fosfor og svovl.
* fosfor + klor → fosfor trichlorid
* Svovl + klor → Svovldichlorid
Sikkerhedshensyn:
Klor er en giftig gas, og dens reaktioner kan være meget eksoterm (frigive en masse varme). Håndtering af klor kræver passende sikkerhedsforholdsregler.
 Varme artikler
Varme artikler
-
 Video:Hvad skal der til for at forvandle Boston havn til te?Kredit:The American Chemical Society Den 16. december 1773, demonstranterne i Bostons tefest smed mere end 340 kister fulde af te – svarende til omkring 18 og en halv million teposer – ind i havne
Video:Hvad skal der til for at forvandle Boston havn til te?Kredit:The American Chemical Society Den 16. december 1773, demonstranterne i Bostons tefest smed mere end 340 kister fulde af te – svarende til omkring 18 og en halv million teposer – ind i havne -
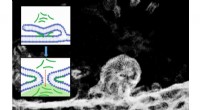 Hvordan trænger peptider ind i celler? To sider af samme møntElektronmikroskopibillede af en todelt cellemembran og det tilsvarende molekylære skema for processen. Kredit:@ IOCB Prag Den simple transport af lægemidler direkte ind i cellerne er et af de prim
Hvordan trænger peptider ind i celler? To sider af samme møntElektronmikroskopibillede af en todelt cellemembran og det tilsvarende molekylære skema for processen. Kredit:@ IOCB Prag Den simple transport af lægemidler direkte ind i cellerne er et af de prim -
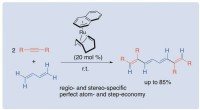 En effektiv tilgang til konjugerede tetraener fra butadien og alkynerEn ny one-pot tilgang af konjugerede tetraener fra 1, 3-butadien og to substituerede acetylener katalyseret af et nulvalent rutheniumkompleks. Kredit:Institut for Anvendt Kemi, Ingeniørskolen, Tokyo U
En effektiv tilgang til konjugerede tetraener fra butadien og alkynerEn ny one-pot tilgang af konjugerede tetraener fra 1, 3-butadien og to substituerede acetylener katalyseret af et nulvalent rutheniumkompleks. Kredit:Institut for Anvendt Kemi, Ingeniørskolen, Tokyo U -
 En ny metode til samtidig behandling af forskellige typer affaldKredit:CC0 Public Domain Et internationalt forskerhold er kommet med en innovativ metode til metalgenvinding fra industriaffald. Den nye metode tillader samtidig genvinding af flere metaller fra s
En ny metode til samtidig behandling af forskellige typer affaldKredit:CC0 Public Domain Et internationalt forskerhold er kommet med en innovativ metode til metalgenvinding fra industriaffald. Den nye metode tillader samtidig genvinding af flere metaller fra s
- Hvilken tilstand er et objekt uden lagret elaktisk energi i flux -ækvilibriumtransitionforvrængnin…
- Hvilken effekt har friktion på et objekts hastighed?
- Hvilken energitransformation for Shredder?
- Sådan forebygger du svindel med økologiske fødevarer
- Hvad er vægtfylde?
- Hvad er en negativ konsekvens af forbrænding af benzin- eller olieprodukter?


