Hvad er det frysepunkt for en opløsning, der indeholder 0,550 mol nal i 615 g vand?
forståelse af koncepterne
* frysningspunktdepression: Tilsætningen af et opløst stof til et opløsningsmiddel sænker opløsningsmidlets frysepunkt. Dette er en kolligativ egenskab, hvilket betyder, at det afhænger af mængden af de tilstedeværende opløste partikler, ikke deres specifikke identitet.
* frysningspunkt depression ligning:
ΔT f =K f * m * i
hvor:
* ΔT f Er frysenpunkt depression (ændring i frysepunktet)
* K f Er frysenpunktdepressionen konstant for opløsningsmidlet (vand =1,86 ° C/m)
* m er molaliteten af opløsningen (mol opløst stof pr. Kg opløsningsmiddel)
* Jeg er Van't Hoff -faktoren (antal partikler, der er opløsning af opløsningen i løsningen)
Beregninger
1. Beregn molaliteten (M):
* Mol opløst stof (NAI) =0,550 mol
* Masse opløsningsmiddel (vand) =615 g =0,615 kg
* Molalitet (m) =mol opløst / kg opløsningsmiddel =0,550 mol / 0,615 kg =0,895 m
2. Bestem van't Hoff -faktoren (i):
* NAI dissocieres i to ioner i opløsning (Na⁺ og I⁻).
* Derfor er jeg =2
3. ):
* ΔT f =K f * m * i =1,86 ° C/m * 0,895 m * 2 =3,34 ° C
4. Beregn det nye frysepunkt:
* Det normale frysepunkt for vand er 0 ° C.
* Ny frysepunkt =0 ° C - 3,34 ° C = -3,34 ° C
Svar: Opløsningens frysepunkt er -3,34 ° C.
Sidste artikelHvad er testreagenset for chloridion?
Næste artikelDen kemiske struktur af ethanol består af?
 Varme artikler
Varme artikler
-
 Opdagelse kan føre til selvkørende robotterForskere opdager, hvordan man laver materialer, der snapper og nulstiller sig selv, kun stole på energistrømmen fra deres omgivelser. Denne forskning kunne muliggøre fremtidige militærrobotter, der er
Opdagelse kan føre til selvkørende robotterForskere opdager, hvordan man laver materialer, der snapper og nulstiller sig selv, kun stole på energistrømmen fra deres omgivelser. Denne forskning kunne muliggøre fremtidige militærrobotter, der er -
 Dobbeltvirkende glat kateter bekæmper bakterierEfter 24 timer, et bakterielt patogen, Pseudomonas aeruginosa (grøn), har fastgjort til en bar glasrute, men ikke til et SLIPS-belagt objektglas, der indeholder et antibakterielt middel. Kredit:David
Dobbeltvirkende glat kateter bekæmper bakterierEfter 24 timer, et bakterielt patogen, Pseudomonas aeruginosa (grøn), har fastgjort til en bar glasrute, men ikke til et SLIPS-belagt objektglas, der indeholder et antibakterielt middel. Kredit:David -
 Et ringbrynjestof, der kan stivne efter behovNTU Asst Prof Wang Yifan bøjer nylon ringbrynje, indkapslet i en plastikkonvolut og vakuumpakket, hvilket gør den 25 gange stivere end normalt. Kredit:NTU Singapore Forskere fra Nanyang Technologi
Et ringbrynjestof, der kan stivne efter behovNTU Asst Prof Wang Yifan bøjer nylon ringbrynje, indkapslet i en plastikkonvolut og vakuumpakket, hvilket gør den 25 gange stivere end normalt. Kredit:NTU Singapore Forskere fra Nanyang Technologi -
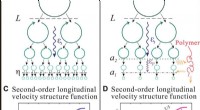 Eksperimentel observation af skalering af det elastiske område i turbulent flow med polymeradditive…Fysisk billede af den turbulente energikaskade og dens manifestation på andenordens longitudinelle hastighedsstrukturfunktion (VSF). (A og B) Tegnefilm, der viser det fysiske billede af energikaskaden
Eksperimentel observation af skalering af det elastiske område i turbulent flow med polymeradditive…Fysisk billede af den turbulente energikaskade og dens manifestation på andenordens longitudinelle hastighedsstrukturfunktion (VSF). (A og B) Tegnefilm, der viser det fysiske billede af energikaskaden


