Hvorfor bruger du ammoniumchlorid snarere end kun vand i Grignard -reaktionen?
Her er en sammenbrud:
* Grignard -reagenser er meget reaktive: De er stærke baser og nukleofiler, hvilket betyder, at de let angriber elektrofiler (som carbonylforbindelser).
* vand er også en elektrofil: Vandmolekyler indeholder et delvist positivt hydrogenatom (på grund af Oxygen's elektronegativitet), hvilket gør dem modtagelige for angreb fra Grignard -reagenser.
* uønskede bivirkninger med vand: Hvis der er vand til stede under Grignard -reaktionen, reagerer grignardreagenset med det og danner en alkan og magnesiumhydroxid. Denne reaktion forbruger Grignard -reagenset, reducerer dens udbytte og gør det nytteløst til den ønskede reaktion med målelektrofilen.
ammoniumchlorid er et mere sikkert alternativ:
* svagt sur: Det er en svag syre, der protonerer Grignard -reagenset (RMGX) og danner en alkan og magnesiumchlorid.
* Effektiv slukning: Denne reaktion forhindrer effektivt grignardreagenset i at reagere med vand eller enhver anden uønsket elektrofil.
* neutralisering: Det neutraliserer også den stærke basale magnesiumhydroxid dannet under slukningsprocessen.
Kortfattet: Ammoniumchlorid bruges til at slukke Grignard -reaktionen, fordi det giver en kontrolleret og effektiv måde at stoppe reaktionen uden at ofre Grignard -reagenset eller indføre uønskede sideprodukter.
Fortæl mig, hvis du har andre spørgsmål!
Sidste artikelHvor mange elektroner låner natrium?
Næste artikelHvordan har arbejdet fra kemikere påvirket miljøet?
 Varme artikler
Varme artikler
-
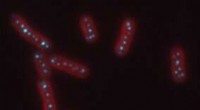 Forståelse af membranen i membranløse organellerPå billedet ses et fluorescensbillede af cyanobakterier, i rødt, med carboxysomer, i cyan. Kredit:Biteen og Vecchiarelli Labs Organeller i celler er små motorer, der indkapsler processer, der till
Forståelse af membranen i membranløse organellerPå billedet ses et fluorescensbillede af cyanobakterier, i rødt, med carboxysomer, i cyan. Kredit:Biteen og Vecchiarelli Labs Organeller i celler er små motorer, der indkapsler processer, der till -
 Kemikere forbedrer brintsensorerFotografi af lagene af palladium og phthalocyaniner på overfladen af elektroden, opnået ved hjælp af et scanningselektronmikroskop (til venstre). Et skematisk billede af sensoren (højre). Kredit:Pav
Kemikere forbedrer brintsensorerFotografi af lagene af palladium og phthalocyaniner på overfladen af elektroden, opnået ved hjælp af et scanningselektronmikroskop (til venstre). Et skematisk billede af sensoren (højre). Kredit:Pav -
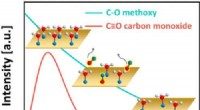 Uventet adfærd set i effektive katalysatorer til ren energiGrafisk abstrakt. Kredit:ACS Catalysis (2022). DOI:10.1021/acscatal.1c05933 Forskere fra Weizmann Institute of Science og US Department of Energys (DOE) Brookhaven National Laboratory har undersøgt
Uventet adfærd set i effektive katalysatorer til ren energiGrafisk abstrakt. Kredit:ACS Catalysis (2022). DOI:10.1021/acscatal.1c05933 Forskere fra Weizmann Institute of Science og US Department of Energys (DOE) Brookhaven National Laboratory har undersøgt -
 Gennembrud skabt ved påvisning af kulstof -urenheder i galliumnitridkrystaller via lysGaN-krystaller under foto-excitation. Kulstofkoncentration fra venstre mod højre:høj, medium, og lav. Kredit:Kazunobu Kojima Kulstofrenhed har længe hindret effektiviteten i nitridbaserede elektro
Gennembrud skabt ved påvisning af kulstof -urenheder i galliumnitridkrystaller via lysGaN-krystaller under foto-excitation. Kulstofkoncentration fra venstre mod højre:høj, medium, og lav. Kredit:Kazunobu Kojima Kulstofrenhed har længe hindret effektiviteten i nitridbaserede elektro
- Resulterer bevægelsen af luft i skydannelse eller hæmmer dannelse?
- Hvad er det bedste eksempel på et stykke maskineri eller udstyr, der indeholder en radiologisk ioni…
- Er det sandt, at energi har masse?
- Hvad er den kemiske ligning for polyethen?
- Estimering af mikroplastikforbrug
- Kan du bruge hydrogenperoxid på piercinger?


