Forekommer kemiske reaktioner altid, når produktet kombineres?
* Kemiske reaktioner involverer brud og dannelse af kemiske bindinger. Produkter er de stoffer, der dannes efter en reaktion, og deres dannelse involverer nye bindinger. Imidlertid garanterer det ikke at blande produkter sammen, at de originale obligationer vil bryde, og der dannes nye.
* reaktioner kræver aktiveringsenergi. For at en reaktion kan forekomme, er reaktanterne nødt til at overvinde en energibarriere (aktiveringsenergi). Produkter har pr. Definition allerede frigivet energi og er i en lavere energistilstand. Bare det at kombinere dem giver muligvis ikke nok energi til at indlede en ny reaktion.
* reaktioner er reversible. Mange reaktioner kan fortsætte i begge retninger:reaktanter, der danner produkter og produkter reformerende reaktanter. Retsretningen afhænger af faktorer som temperatur, koncentration og tryk. Bare fordi produkter er til stede, betyder det ikke, at den omvendte reaktion sker.
Eksempel:
Tænk på brændende træ. Træ (reaktant) reagerer med ilt (reaktant) for at producere aske, kuldioxid og vand (produkter). Hvis du kombinerer aske, kuldioxid og vand, vil de ikke spontant vende tilbage til træ og ilt. Dette skyldes, at reaktionen kræver meget energi (leveret af forbrændingsvarmen).
Kortfattet:
* Kemiske reaktioner handler om at bryde og danne bindinger.
* Produkter er resultatet af en reaktion, ikke nødvendigvis dens årsag.
* Kombination af produkter vender ikke automatisk den originale reaktion.
Sidste artikelHvilken syre opløser tinoxid?
Næste artikelHvad er den afbalancerede ligning for kobber 2 brom?
 Varme artikler
Varme artikler
-
 Kompleks stofskifte kan have samlet sig selv fra simple prækursorerEn reaktion af thioeddikesyre, thioler og jernproducerende thioestere og et jernsulfidmineral. Kredit:Sebastian Sanden, ELSI. Alt moderne liv bruger energi til at reproducere sig selv. Under denne
Kompleks stofskifte kan have samlet sig selv fra simple prækursorerEn reaktion af thioeddikesyre, thioler og jernproducerende thioestere og et jernsulfidmineral. Kredit:Sebastian Sanden, ELSI. Alt moderne liv bruger energi til at reproducere sig selv. Under denne -
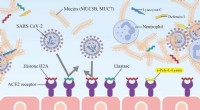 Ny nøglebeskyttelse mod COVID-19 fundet i spytSARS-CoV-2 overføres ved binding af spike-proteinet S1 på den virale kappe til den angiotensin-konverterende enzym 2 (ACE2)-receptor på plasmamembranen af humane celler. Histon H2A og elastaseprotei
Ny nøglebeskyttelse mod COVID-19 fundet i spytSARS-CoV-2 overføres ved binding af spike-proteinet S1 på den virale kappe til den angiotensin-konverterende enzym 2 (ACE2)-receptor på plasmamembranen af humane celler. Histon H2A og elastaseprotei -
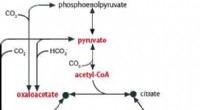 Opdagelse af et oprindeligt metabolisk system, der giver os et glimt af livets oprindelse på JordenFig. 1:Forholdet mellem TCA -cyklussen og pyruvat, acetyl-CoA, oxaloacetat, oxoglutarat, og succinyl-CoA er vist. Kredit:Hokkaido University Multi-omics forskning på Thermosulfidibacter (isoleret
Opdagelse af et oprindeligt metabolisk system, der giver os et glimt af livets oprindelse på JordenFig. 1:Forholdet mellem TCA -cyklussen og pyruvat, acetyl-CoA, oxaloacetat, oxoglutarat, og succinyl-CoA er vist. Kredit:Hokkaido University Multi-omics forskning på Thermosulfidibacter (isoleret -
 Lavpris solcelledrevet vandfilter fjerner bly, andre forurenende stofferI en undersøgelse foretaget ved Princeton University, forskere placerede gelen i søvand, hvor den absorberede rent vand, efterlader forurenende stoffer. Forskerne placerede derefter gelen i solen, hvo
Lavpris solcelledrevet vandfilter fjerner bly, andre forurenende stofferI en undersøgelse foretaget ved Princeton University, forskere placerede gelen i søvand, hvor den absorberede rent vand, efterlader forurenende stoffer. Forskerne placerede derefter gelen i solen, hvo
- Hvilken slags eksperimenter gennemførte Humphrey Davy?
- Kvantebølger i hjertet af organiske solceller
- Uberørt rumsten giver NASA-forskere et kig på udviklingen af livets byggesten
- Hvad er de to hovedtyper af energi, der vedrører bevægelse?
- Hvilke kræfter modtager energi fra jordens interiør?
- Ny forskning tyder på tilstedeværelsen af ukonventionelle galakser, der indeholder to sorte hull…


