Hvilken forbindelse har ikke en bøjet molekylær form?
Forståelse af molekylære former
Molekylær form bestemmes af arrangementet af elektronpar omkring et centralt atom. De mest almindelige former er:
* lineær: To elektronpar omkring det centrale atom, hvilket resulterer i en lige linje.
* bøjet/V-formet: To bindingspar og to ensomme par elektroner omkring det centrale atom, hvilket skaber en bøjet form.
* trigonal plan: Tre elektronpar omkring det centrale atom, der danner en flad trekant.
* tetrahedral: Fire elektronpar omkring det centrale atom, der danner en pyramide med en trekantet base.
Identificering af forbindelsen
For at bestemme, hvilken forbindelse der ikke er bøjet, er vi nødt til at se på det centrale atom og dets bindings- og enlige parelektroner. Her er nogle almindelige eksempler:
* vand (H₂O): Det centrale atom er ilt, der har to ensomme par og to bindingspar. Dette resulterer i en bøjet form.
* kuldioxid (co₂): Det centrale atom er kulstof, der har to dobbeltbindinger til iltatomer. Disse bindinger er lineære, hvilket resulterer i et lineært molekyle.
* ammoniak (NH₃): Det centrale atom er nitrogen, der har et ensomt par og tre bindingspar. Dette resulterer i en trigonal pyramidal form.
* methan (ch₄): Det centrale atom er kulstof, der har fire bindingspar. Dette resulterer i en tetrahedral form.
Svar
Forbindelsen, der ikke har en bøjet molekylær form, er kuldioxid (co₂) .
Sidste artikelHvad er processen, der forvandler vanddamp til flydende vand?
Næste artikelHvad er opløset ilt?
 Varme artikler
Varme artikler
-
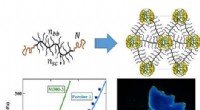 Polymerer, der efterligner kamæleons hudØverst til venstre:molekylær struktur af en plastomer syntetiseret i dette værk; højre:supramolekylær struktur dannet ved samling af identiske plastomerer. Nederst-til venstre:belastningskurver til pl
Polymerer, der efterligner kamæleons hudØverst til venstre:molekylær struktur af en plastomer syntetiseret i dette værk; højre:supramolekylær struktur dannet ved samling af identiske plastomerer. Nederst-til venstre:belastningskurver til pl -
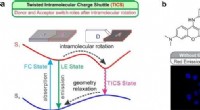 Forskere opdager ny ladningsoverførsel og adskillelsesproces(a) Skematisk illustration af de twisted intramolecular charge shuttle (TICS) mekanismer; D og A betegner elektrondonerende og elektronaccepterende fragmenter, henholdsvis. (b) Reaktionsmekanisme for
Forskere opdager ny ladningsoverførsel og adskillelsesproces(a) Skematisk illustration af de twisted intramolecular charge shuttle (TICS) mekanismer; D og A betegner elektrondonerende og elektronaccepterende fragmenter, henholdsvis. (b) Reaktionsmekanisme for -
 Gennembrud i forståelsen af enzymer, der laver antibiotika til lægemiddelresistent patogenProf Józef Lewandowski udfører nuklear magnetisk resonansspektroskopi, en nøgleteknikker brugt i arbejdet. Kredit:University of Warwick En af WHOs tre kritiske prioriterede patogener, Acinetobacte
Gennembrud i forståelsen af enzymer, der laver antibiotika til lægemiddelresistent patogenProf Józef Lewandowski udfører nuklear magnetisk resonansspektroskopi, en nøgleteknikker brugt i arbejdet. Kredit:University of Warwick En af WHOs tre kritiske prioriterede patogener, Acinetobacte -
 Dit medicinske implantat eller madindpakning kan en dag være lavet af CBDDenne smelteforarbejdelige CBD-baserede polymer ser ud og fungerer som et typisk stykke plastik med et strejf af antioxidantaktivitet. Kredit:Tilpasset fra ACS Applied Materials &Interfaces 2022. DOI:
Dit medicinske implantat eller madindpakning kan en dag være lavet af CBDDenne smelteforarbejdelige CBD-baserede polymer ser ud og fungerer som et typisk stykke plastik med et strejf af antioxidantaktivitet. Kredit:Tilpasset fra ACS Applied Materials &Interfaces 2022. DOI:
- Brug af E. coli til at skabe bioprodukter, som biodiesel, på en omkostningseffektiv måde
- Astronomer måler detaljerede kemiske mængder af 158 stjerner i en nærliggende dværggalakse
- Hvad sker der med lys, når det bevæger sig i en vinkel ind i et medium, der har lavere brydningsin…
- Guldkopi af amerikansk rummodul klemt fra Ohio museum
- Hvad er mængden af potentiel energi pr. Enhedsafgift, som en statisk eller elektrisk strøm har?
- Hvor er de 3 store jordskælvsbælter?


