Hvilken type intermolekylær kraft forårsager opløsningen NaCl i vand?
* NaCl: Natriumchlorid er en ionisk forbindelse. Dette betyder, at det findes som et krystalgitter af positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-).
* Vand: Vand er et polært molekyle. Oxygenatomet har en delvis negativ ladning, mens brintatomerne har delvis positive ladninger.
hvordan det fungerer:
1. attraktion: De delvist negative iltatomer af vandmolekyler tiltrækkes af de positivt ladede natriumioner (Na+). Tilsvarende tiltrækkes de delvist positive hydrogenatomer af vandmolekyler af de negativt ladede chloridioner (Cl-).
2. Omgivende: Vandmolekyler omgiver ionerne og danner hydratiseringsskaller. Disse skaller isolerer effektivt ionerne fra hinanden og bryder den ioniske gitter fra hinanden.
3. opløsning: Efterhånden som flere vandmolekyler omgiver og isolerer ionerne, bryder krystalgitteret sammen, og NaCl opløses i vand.
Kortfattet: De polære vandmolekyler interagerer med deres delvise ladninger stærkt med de ladede ioner af NaCl, hvilket får saltet til at opløses.
Sidste artikelHvor mange valenselektroner har et atom fra gruppe 16?
Næste artikelEr den største mængde gas i luft ilt?
 Varme artikler
Varme artikler
-
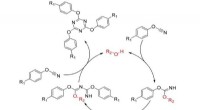 Kemikere tilbyder et nyt kig på polymerer til rumindustrienMekanisme for cyklotrimerisering af cyanatestere. Kredit:Kazan Federal University Medarbejdere ved Institut for Fysisk Kemi ved Kazan Federal University har fundet ud af, at mekanismerne til polym
Kemikere tilbyder et nyt kig på polymerer til rumindustrienMekanisme for cyklotrimerisering af cyanatestere. Kredit:Kazan Federal University Medarbejdere ved Institut for Fysisk Kemi ved Kazan Federal University har fundet ud af, at mekanismerne til polym -
 Robust fast katalysator giver høje udbytter af estere ved kontinuerlig strømningFigur 1:At gå tilbage til gymnasiekemi gjorde det muligt for RIKEN-kemikere at udvikle en katalysator, der kan producere estere ved høje udbytter i en kontinuerlig flow-proces. Kredit:Andrew Lambert P
Robust fast katalysator giver høje udbytter af estere ved kontinuerlig strømningFigur 1:At gå tilbage til gymnasiekemi gjorde det muligt for RIKEN-kemikere at udvikle en katalysator, der kan producere estere ved høje udbytter i en kontinuerlig flow-proces. Kredit:Andrew Lambert P -
 Rust tilbyder en billig måde at filtrere arsenforgiftet vand påKredit:SLAC National Accelerator Laboratory Når vandet strømmer dybt under jorden, det opløser ofte uorganiske stoffer fra mineralforekomster i jordskorpen. I mange regioner, disse aflejringer ind
Rust tilbyder en billig måde at filtrere arsenforgiftet vand påKredit:SLAC National Accelerator Laboratory Når vandet strømmer dybt under jorden, det opløser ofte uorganiske stoffer fra mineralforekomster i jordskorpen. I mange regioner, disse aflejringer ind -
 Se, hvordan en kovalent polymer udvikler sig ved hjælp af et scanningstunnelmikroskopUorden-til-orden overgang. Kredit:Nature (2022). DOI:10.1038/s41586-022-04409-6 Et team af forskere fra KU Leuven, University of Aveiro, OLYMAT, University of the Basque Country UPV/EHU og Ikerbasq
Se, hvordan en kovalent polymer udvikler sig ved hjælp af et scanningstunnelmikroskopUorden-til-orden overgang. Kredit:Nature (2022). DOI:10.1038/s41586-022-04409-6 Et team af forskere fra KU Leuven, University of Aveiro, OLYMAT, University of the Basque Country UPV/EHU og Ikerbasq
- Epigenetik forklarer, hvorfor dit DNA ikke forudsiger din skæbne
- Hvorfor er det vigtigt, at videnskabsmand kender og accepterer deres begrænsninger?
- Undersøgelse viser, hvordan antibiotika opsætter vejspærringer for at dræbe bakterier
- Grotteforekomster viser overraskende skift i permafrost i løbet af de sidste 400, 000 år
- En akilleshæl for Wii's popularitet?
- Hvad er den solide form for magma -krop?


