Brug af elektronegativitetsværdier Hvilken type binding forventes mellem brint og svovl?
1. Elektronegativitetsværdier:
* brint (H): 2.20
* svovl (er): 2,58
2. Elektronegativitetsforskel:
Træk den mindre elektronegativitetsværdi fra den større:
2,58 (s) - 2,20 (h) =0,38
3. Klassificering af obligationstype:
* ionisk: Elektronegativitetsforskel ≥ 1,7
* polær kovalent: Elektronegativitetsforskel mellem 0,5 og 1,7
* ikke -polær kovalent: Elektronegativitetsforskel <0,5
Konklusion:
Elektronegativitetsforskellen mellem brint og svovl (0,38) falder inden for området for polære kovalente bindinger . Dette betyder, at elektronerne i bindingen ikke deles lige. Svovl, der er mere elektronegativ, vil tiltrække elektronerne stærkere og skabe en delvis negativ ladning på svovlatomet og en delvis positiv ladning på brintatomet.
Sidste artikelHvad er det kemiske navn på jernmalm?
Næste artikelHvilken forbindelse er BE3 PO4 2?
 Varme artikler
Varme artikler
-
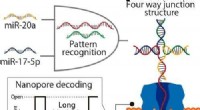 Nanopore-teknologi med DNA-beregning registrerer let mikroRNA-mønstre af lungekræftDNAer genkendte autonomt to mikroRNAer, miR-20a og miR-17-5p, og dannede en fire-vejs forbindelsesstruktur, der blev fanget i nanopore, viser lange blokeringsstrømme. Kredit:Figur tilpasset med tillad
Nanopore-teknologi med DNA-beregning registrerer let mikroRNA-mønstre af lungekræftDNAer genkendte autonomt to mikroRNAer, miR-20a og miR-17-5p, og dannede en fire-vejs forbindelsesstruktur, der blev fanget i nanopore, viser lange blokeringsstrømme. Kredit:Figur tilpasset med tillad -
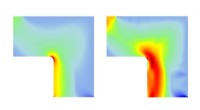 Materialegradienter kunne styrke polymerkomponenterGengivelser af, hvordan belastningen er fordelt på tværs af et L-formet beslag, der udelukkende er lavet af en stiv polymer (venstre) vs. et beslag med både stive og fleksible polymerer (højre). Kredi
Materialegradienter kunne styrke polymerkomponenterGengivelser af, hvordan belastningen er fordelt på tværs af et L-formet beslag, der udelukkende er lavet af en stiv polymer (venstre) vs. et beslag med både stive og fleksible polymerer (højre). Kredi -
 Den nuværende model til opbevaring af atomaffald er ufuldstændigKredit:CC0 Public Domain De materialer, USA og andre lande planlægger at bruge til at opbevare atomaffald på højt niveau, vil sandsynligvis nedbrydes hurtigere end nogen tidligere kendte på grund
Den nuværende model til opbevaring af atomaffald er ufuldstændigKredit:CC0 Public Domain De materialer, USA og andre lande planlægger at bruge til at opbevare atomaffald på højt niveau, vil sandsynligvis nedbrydes hurtigere end nogen tidligere kendte på grund -
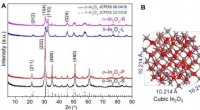 Effektive indiumoxidkatalysatorer designet til CO2-hydrogenering til methanolKredit:Chinese Academy of Sciences Katalytisk hydrogenering af kuldioxid (CO 2 ) er et grønt og bæredygtigt middel til at syntetisere råvarekemikalier såsom methanol. Denne konverteringsproces e
Effektive indiumoxidkatalysatorer designet til CO2-hydrogenering til methanolKredit:Chinese Academy of Sciences Katalytisk hydrogenering af kuldioxid (CO 2 ) er et grønt og bæredygtigt middel til at syntetisere råvarekemikalier såsom methanol. Denne konverteringsproces e
- Billede:Test af astronauter lungesundhed
- Den første sorte astroant dræbt på udfordrerens rumfartøj?
- Hvad bruges olie til i de indvendige sletter?
- Hvad er et andet ord, der bruger sol, men ikke system?
- Hvad quadrivium bestod af fire emner aritmetisk musik og astronomi.?
- Hvad er unikt ved ask-faldende fossiler?


