Hvor mange elektroner er der i den ydre skal af gallium?
* Elektronkonfiguration: Elektronkonfigurationen af gallium er [AR] 3D 10 4S 2 4p 1 .
* ydre skal: Den yderste skal til gallium er den 4. skal (n =4).
* Valenselektroner: Elektronerne i den yderste skal kaldes valenselektroner. I dette tilfælde er der 3 valenselektroner (2 ud af 4s og 1 ud af 4p).
* mest reaktive elektron: Mens gallium har tre valenselektroner, er den i 4P -underskalet den mest reaktive og deltager i kemisk binding.
Derfor, når man overvejer den ydre skal til kemisk binding, fungerer gallium effektivt som om den har 1 Elektron i dets ydre skal.
 Varme artikler
Varme artikler
-
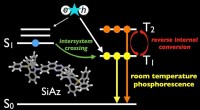 Spændende tider for effektiv, tung-atom-fri OLED'erFigur 1:Strukturen af udviklet stuetemperatur-phosphorescensmateriale (SiAz) og illustrativt resumé af dette arbejde. Kredit:Osaka University Organic light-emitting diode (OLED)-skærme er nu meg
Spændende tider for effektiv, tung-atom-fri OLED'erFigur 1:Strukturen af udviklet stuetemperatur-phosphorescensmateriale (SiAz) og illustrativt resumé af dette arbejde. Kredit:Osaka University Organic light-emitting diode (OLED)-skærme er nu meg -
 Hydrogelcoating er den første til at forhindre isdannelse på 3 forskellige måderBelægningen kunne være en billig løsning til at forhindre udendørs rør, flyvingekomponenter og andet udstyr fra at fryse i kolde temperaturer. Kredit:iStock.com/fotograff Materialeforskere ved UCL
Hydrogelcoating er den første til at forhindre isdannelse på 3 forskellige måderBelægningen kunne være en billig løsning til at forhindre udendørs rør, flyvingekomponenter og andet udstyr fra at fryse i kolde temperaturer. Kredit:iStock.com/fotograff Materialeforskere ved UCL -
 Forskere udvikler en ny klasse af undervandslimFotografi af det fremstillede fleksible sammenklæbende klæbemiddel (til venstre) og et SEM -billede (i midten) af PEGDMA mikrokrogarrays af klæbemidlet. Til højre er den konceptuelle illustration af d
Forskere udvikler en ny klasse af undervandslimFotografi af det fremstillede fleksible sammenklæbende klæbemiddel (til venstre) og et SEM -billede (i midten) af PEGDMA mikrokrogarrays af klæbemidlet. Til højre er den konceptuelle illustration af d -
 Fiksering af pulverkatalysatorer på elektroderDen nye metode udviklet af Corina Andronescu (i midten) og Stefan Barwe (til venstre for hende) sammen med deres kolleger, er potentielt interessant for den elektrokemiske brintproduktion. Kredit:RUB,
Fiksering af pulverkatalysatorer på elektroderDen nye metode udviklet af Corina Andronescu (i midten) og Stefan Barwe (til venstre for hende) sammen med deres kolleger, er potentielt interessant for den elektrokemiske brintproduktion. Kredit:RUB,
- Hvilken type partikler handler den stærke atomkraft?
- Hvad kaldes et hul i den geologiske rekord, konserveret klippe?
- Sidder universet fast i en Groundhog Day?
- Kunstig intelligens identificerer den optimale materialeformel
- Ny type indendørs solceller til smarte tilsluttede enheder
- Nobelprissæsonen ankommer midt i krig, nuklear frygt, sult


