Er ammoniak mlecule NH3 mere polært end vandmolekyle?
Her er hvorfor:
* Elektronegativitetsforskel: Oxygen (O) er mere elektronegativ end nitrogen (N). Dette betyder, at iltatomet i vand tiltrækker de delte elektroner i O-H-bindingerne stærkere end nitrogenatomet i ammoniak tiltrækker de delte elektroner i N-H-bindingerne. Dette skaber en større delvis negativ ladning på iltatomet i vand sammenlignet med nitrogenatomet i ammoniak.
* molekylær geometri: Både vand og ammoniak har en bøjet molekylær geometri på grund af tilstedeværelsen af ensomme par på det centrale atom. Imidlertid er det ensomme par på nitrogenatomet i ammoniak mindre og mindre elektrontæt sammenlignet med de ensomme par på iltatomet i vand. Dette bidrager til et svagere dipolmoment i ammoniak.
* dipolmoment: Dipolmomentet, som er et mål for polariteten af et molekyle, er højere for vand (1,85 d) end for ammoniak (1,47 d). Dette indikerer, at vandmolekylet har en stærkere adskillelse af ladning og derfor er mere polær.
Kortfattet:
Mens både ammoniak og vand er polære molekyler, er vand mere polær på grund af dets højere elektronegativitetsforskel, større ensomme par og stærkere dipolmoment.
 Varme artikler
Varme artikler
-
 Beskadigede planter og falske parfumer kan identificeres hurtigt og pålideligt i realtidHarpiksen, der udskilles af et beskadiget nåletræ for at beskytte skadestedet, har sin egen karakteristiske chirale signatur inden for anlæggets samlede emissioner. Kredit:Lykourgos Bougas Den chir
Beskadigede planter og falske parfumer kan identificeres hurtigt og pålideligt i realtidHarpiksen, der udskilles af et beskadiget nåletræ for at beskytte skadestedet, har sin egen karakteristiske chirale signatur inden for anlæggets samlede emissioner. Kredit:Lykourgos Bougas Den chir -
 Undersøgelse finder fluor som mulig erstatning for lithium i genopladelige batterierHer, lagdelte elektroder, såsom Ca2N og Y2C - der har en elektron, der optager et gittersted - forudsiges som lovende værter for fluorid-interkalation, fordi deres anioniske elektroner skaber store me
Undersøgelse finder fluor som mulig erstatning for lithium i genopladelige batterierHer, lagdelte elektroder, såsom Ca2N og Y2C - der har en elektron, der optager et gittersted - forudsiges som lovende værter for fluorid-interkalation, fordi deres anioniske elektroner skaber store me -
 Forskere udvikler en ny raman-spektroskopiplatform til at karakterisere IDP'er i fortyndet opløsnin…En illustration, der viser det optiske pincet-kontrollerede hotspot til proteinstrukturkarakteriseringen ved overfladeforstærket Raman-spektroskopi. Kredit:Vince St. Dollente Mesias, Jinqing Huang / H
Forskere udvikler en ny raman-spektroskopiplatform til at karakterisere IDP'er i fortyndet opløsnin…En illustration, der viser det optiske pincet-kontrollerede hotspot til proteinstrukturkarakteriseringen ved overfladeforstærket Raman-spektroskopi. Kredit:Vince St. Dollente Mesias, Jinqing Huang / H -
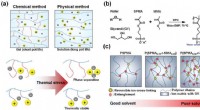 Et termometer, der kan strækkes og deformeres af vandVirkningerne af ionisk sidekæde. a) Skema, der angiver forskel med hensyn til brugstid og termisk stabilitet i henhold til kemiske og fysiske metoder. b) Skema for P(SPMA-r-MMA)er og vandopløselighed.
Et termometer, der kan strækkes og deformeres af vandVirkningerne af ionisk sidekæde. a) Skema, der angiver forskel med hensyn til brugstid og termisk stabilitet i henhold til kemiske og fysiske metoder. b) Skema for P(SPMA-r-MMA)er og vandopløselighed.
- Hvad er den nøjagtige repræsentation af solsystemets kredsløb til skala?
- Hvilket brændstof er det bedste?
- Hvad er store gaskugler, der skaber og udsender deres egen stråling?
- Skal Mark Zuckerberg være Facebooks bestyrelsesformand og administrerende direktør? Nogle investor…
- Træer, der vokser i saltvand
- Hvad er relateret til hvor meget kraft der har brug for at ændre en objekter bevægelse?


