Hvad er valenselektroner, og hvad bestemmer de?
Valenselektroner:nøglen til kemisk binding
Valenselektroner er elektronerne i den yderste skal af et atom. Det er dem, der er involveret i kemisk binding og bestemmer et elements kemiske egenskaber. Her er en sammenbrud:
Hvad er de?
* yderste skal: Valenselektroner ligger i det højeste energiniveau af et atom. Tænk på det som det "yderste lag" af en løg.
* aktive deltagere: I modsætning til elektroner i indre skaller er valenselektroner ikke tæt bundet til kernen. De kan let opnås, mistes eller deles med andre atomer og danner kemiske bindinger.
hvad bestemmer de?
* reaktivitet: Elementer med få valenselektroner har en tendens til let at få elektroner for at opnå en stabil konfiguration (som ædelgasser). Omvendt er elementer med mange valenselektroner tilbøjelige til at miste elektroner. Denne reaktivitet bestemmer, hvor let et element danner kemiske bindinger.
* limningstype: Valenselektroner dikterer den type binding, et element, danner:
* ioniske bindinger: Overførsel af valenselektroner mellem et metal (mister elektroner) og en ikke-metal (får elektroner).
* kovalente obligationer: Deling af valenselektroner mellem ikke-metaler.
* Oxidationstilstand: Antallet af elektroner, som et atomgevinster eller mister for at opnå stabilitet, afspejler dens oxidationstilstand. Denne værdi er vigtig i kemiske reaktioner og forståelse af atomernes rolle i forbindelser.
* Kemiske egenskaber: Den måde, et element opfører sig i kemiske reaktioner, er direkte knyttet til dets valenselektronkonfiguration. For eksempel udviser elementer med lignende valenselektronkonfigurationer ofte lignende kemiske egenskaber.
I et nøddeskal: Valenselektroner er som atomets "sociale sommerfugle", der bestemmer, hvordan det interagerer med andre atomer og forme dets kemiske opførsel.
Eksempler:
* natrium (NA): Har 1 valenselektron i sin yderste skal, hvilket gør det meget reaktivt og sandsynligvis mister dette elektron til at danne en positiv ion (Na+).
* ilt (O): Har 6 valenselektroner, der har brug for 2 mere for at opnå stabilitet. Dette gør det reaktivt og sandsynligvis får 2 elektroner til at danne en negativ ion (O2-).
* carbon (c): Har 4 valenselektroner, der giver den mulighed for at danne 4 kovalente bindinger, hvilket forklarer dens enorme vifte af organiske forbindelser.
Forståelse af valenselektroner er afgørende for at forstå, hvordan atomer kombineres for at danne molekyler og forbindelser, og hvordan kemiske reaktioner forekommer. Det er grundlaget for kemisk binding og grundlaget for at forudsige kemisk opførsel.
 Varme artikler
Varme artikler
-
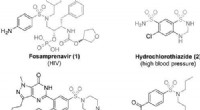 Elektrokemi åbner vej til en bæredygtig kilde til sulfonamider for lægemiddelproducenterSulfonamidholdige lægemidler. Kredit:Sulfonamidholdige lægemidler. Kredit: Et forskerhold ved Johannes Gutenberg University Mainz (JGU) i Tyskland har udviklet en helt ny, miljøvenlig elektrokemisk
Elektrokemi åbner vej til en bæredygtig kilde til sulfonamider for lægemiddelproducenterSulfonamidholdige lægemidler. Kredit:Sulfonamidholdige lægemidler. Kredit: Et forskerhold ved Johannes Gutenberg University Mainz (JGU) i Tyskland har udviklet en helt ny, miljøvenlig elektrokemisk -
 Maskinlæring kunne lære os, hvordan man gør fremstilling af materialer renere og mere bæredygtigMaskinlæring og design af eksperimenter kan kombineres for at identificere den mest bæredygtige metode til udvikling af avancerede materialer. Kredit:020 KAUST; Xavier Pita Kemi computeralgoritme
Maskinlæring kunne lære os, hvordan man gør fremstilling af materialer renere og mere bæredygtigMaskinlæring og design af eksperimenter kan kombineres for at identificere den mest bæredygtige metode til udvikling af avancerede materialer. Kredit:020 KAUST; Xavier Pita Kemi computeralgoritme -
 Kunstig intelligens kaster lys over membranydelsenKredit:King Abdullah University of Science and Technology Membranseparationer har længe været anerkendt som energieffektive processer med et hurtigt voksende marked. I særdeleshed, organisk opløsn
Kunstig intelligens kaster lys over membranydelsenKredit:King Abdullah University of Science and Technology Membranseparationer har længe været anerkendt som energieffektive processer med et hurtigt voksende marked. I særdeleshed, organisk opløsn -
 Forskere udvikler et fast materiale med mobile partikler, der reagerer på miljøetVed høje temperaturer (venstre) bevæger partikler sig frit i dråberne og giver materialet en rubinrød farve; de agglomererer ved lavere temperaturer (til højre) og ændrer materialets farve til gråviol
Forskere udvikler et fast materiale med mobile partikler, der reagerer på miljøetVed høje temperaturer (venstre) bevæger partikler sig frit i dråberne og giver materialet en rubinrød farve; de agglomererer ved lavere temperaturer (til højre) og ændrer materialets farve til gråviol
- Hvilke stoffer ville være en god elektrisk leder?
- Hvad er et produkt af et objekts masse gange dets hastighed?
- Hvad er forholdet mellem kraft et momentum?
- Udvikling af avanceret materialesynteseteknologi i metastabil fase
- Hvad er radikal oxidation?
- Forskere afslører kritisk metabolisk switch for inflammatoriske sygdomme


