H3PO4, der indeholder tre hydrogenatomer pr. Molekyle, er en svag syre, hvorimod HCL kun en atom stærk forklarer hvorfor?
styrken af en syre bestemmes af dens evne til at donere en proton (H+) i opløsning.
* HCL er en stærk syre Fordi det let donerer sin enkelt proton til vand, danner H₃O+ (hydroniumion) og Cl- (chloridion). Denne dissociation er i det væsentlige komplet i opløsning, hvilket betyder, at de fleste HCL -molekyler donerer deres proton.
* h₃po₄ er en svag syre Fordi det kun delvist donerer sine protoner i løsning. Det gennemgår en række ioniseringstrin, hvor hver efterfølgende proton er vanskeligere at fjerne. Det første ioniseringstrin producerer H₂po₄- (dihydrogenphosphation), det andet trin producerer HPO₄²⁻ (hydrogenphosphation), og det sidste trin producerer Po₄³⁻ (phosphation). Hvert trin har sin egen ligevægtskonstant (KA), og Ka -værdierne falder med hver ionisering, hvilket indikerer, at fjernelse af hver efterfølgende proton er mindre gunstig.
Her er nøglen:
* Styrke af en syre er ikke direkte relateret til antallet af brintatomer.
* det afhænger af stabiliteten af den konjugatbase, der er dannet efter, at protonen er doneret.
I tilfælde af HCL er clionen meget stabil, hvilket gør dissociationen af HCL meget gunstig.
I tilfælde af H₃po₄ er konjugatbaserne (H₂po₄⁻, HPO₄²⁻ og Po₄³⁻) mindre stabile på grund af den negative ladningsfordeling over flere iltatomer. Dette gør det vanskeligere for syren at miste sine protoner og forklarer, hvorfor H₃po₄ er en svag syre.
Fortæl mig, hvis du gerne vil have flere detaljer om de faktorer, der påvirker syrestyrke!
Sidste artikelHvorfor har metan og siliciumdioxid forskellige smeltepunkter?
Næste artikelHvilken type blanding er kobbertråd i sølvnitrat?
 Varme artikler
Varme artikler
-
 Nedbrydelige sukkerbaserede polymerer kan lagre og frigive nyttig molekylær fragtKredit:CC0 Public Domain Nedbrydeligt, biobaserede polymerer tilbyder muligheder for kemisk genbrug, og de kan være et redskab til at lagre og frigive nyttige molekyler. Forskere har udviklet en k
Nedbrydelige sukkerbaserede polymerer kan lagre og frigive nyttig molekylær fragtKredit:CC0 Public Domain Nedbrydeligt, biobaserede polymerer tilbyder muligheder for kemisk genbrug, og de kan være et redskab til at lagre og frigive nyttige molekyler. Forskere har udviklet en k -
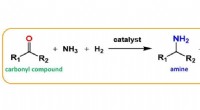 For meget aktive, bæredygtige katalysatorer, bare tilsæt fosforFig. 1. Reduktiv amination af carbonylforbindelser. Kredit:Osaka University Katalysatorer er afgørende for at gøre industrielle processer levedygtige. Imidlertid, mange af de ikke-ædelmetalkatalys
For meget aktive, bæredygtige katalysatorer, bare tilsæt fosforFig. 1. Reduktiv amination af carbonylforbindelser. Kredit:Osaka University Katalysatorer er afgørende for at gøre industrielle processer levedygtige. Imidlertid, mange af de ikke-ædelmetalkatalys -
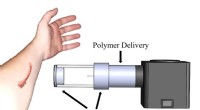 Sprøjt maling af fiberbind på sårIllustration af den elektrostatiske og luftdrevne enhed opsat til direkte afsætning af en bandage på et sårsted. Kredit:L.G. Huston og E.A. Kooistra-Manning, Montana teknologiske universitet Med n
Sprøjt maling af fiberbind på sårIllustration af den elektrostatiske og luftdrevne enhed opsat til direkte afsætning af en bandage på et sårsted. Kredit:L.G. Huston og E.A. Kooistra-Manning, Montana teknologiske universitet Med n -
 Undersøgelsesresultater baner vejen for programmerbare elektroniske blækMengmeng Li og René Janssen. Kredit:Eindhoven University of Technology Konjugerede polymerer er vigtige materialer på grund af deres specielle elektroniske og optiske egenskaber og lave omkostning
Undersøgelsesresultater baner vejen for programmerbare elektroniske blækMengmeng Li og René Janssen. Kredit:Eindhoven University of Technology Konjugerede polymerer er vigtige materialer på grund af deres specielle elektroniske og optiske egenskaber og lave omkostning
- Hvad er en sesmograf?
- Jord, der indeholder store mængder calcium, er højst sandsynligt dannet ved forvitring af?
- Forekommer solflekker på overfladen af solen?
- Et dybt dyk på Kraken, et skibbrudende havmonster
- Hvilke ordforråds vilkår er relateret til energi?
- Et forslag til Juno om at observere vulkanerne i Io


